您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-06-10 11:32
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
甘莱FXR激动剂获批胆管炎临床。歌礼旗下甘莱制药FXR激动剂ASC42获FDA批准,即将开展一项用于治疗原发性胆汁性胆管炎的关键性药物-药物相互作用(DDI)研究,以支持后续在中国、美国和欧盟开展III期临床。I期临床数据显示,ASC42(15mg)治疗14天后,受试者的低密度脂蛋白胆固醇维持在正常水平且未观察到出现瘙痒症状;而且FXR靶向激活的生物标志物FGF19增幅高达1,780%。
国内药讯
1.复宏汉霖PD-1肺癌III期临床积极。复宏汉霖PD-1斯鲁利单抗(汉斯状®)在ASCO2022年会上公布一线治疗广泛期小细胞肺癌(ES-SCLC)的国际III期临床(ASTRUM-005)研究成果。中位随访为12.3个月,斯鲁利单抗组和安慰剂组的中位OS分别为15.4个月(95% CI 13.3–NE)和10.9个月(95% CI 10.0–14.3),风险比(HR)为0.63(95% CI 0.49–0.82,p<0.001);两组两年总生存率分别为43.1%和7.9%,IRRC评估的中位PFS分别为5.7和4.3个月(HR 0.48,95% CI 0.38–0.59)。
2.绿叶抗抑郁新药Ⅲ期临床积极。绿叶制药三重再摄取抑制剂新药LY03005在APA2022年会上发布用于治疗抑郁症的Ⅲ期研究成果。数据显示,LY03005(80mg、160mg)两个剂量组8周末的MADRS(蒙哥马利-艾斯伯格抑郁量表)总分较基线的变化值均优于安慰剂组,两组较安慰剂组的LSM差值分别为-5.46和-5.06,均具有统计学意义。LY03005组的HAM-D17评分、MADRS有效率(79.9%和73.9%)和MADRS缓解率(51.6%和52.2%)均显著优于安慰剂组。此外,LY03005耐受良好,不影响性功能。
3.嘉葆药银抗肿瘤新药获批临床。上海嘉葆药银公司小分子1类新药JDB383片获CDE临床试验默示许可,拟用于腱鞘巨细胞瘤的治疗。JDB383是一款集落刺激因子(CSF1R)抑制剂,CSF1(二聚体糖蛋白)主要存在于骨髓腔内,负责巨噬细胞的生长、增殖和分化等细胞过程。JDB383经临床前人源化PDX模型验证药效显著,并呈剂量依赖性增长。
4.复旦张江抗体偶联剂报IND。上海复旦张江注射用FDA022抗体偶联剂的临床试验申请获CDE受理。注射用FDA022抗体偶联剂是由针对人表皮生长因子受体2(HER2)靶点的单抗与BB05偶联组成。该药物通过与HER2表达的肿瘤细胞结合并内吞,在溶酶体内通过蛋白酶剪切定向释放小分子细胞毒药物,杀伤肿瘤细胞。该药物拟开发用于治疗HER2阳性的乳腺癌、胃癌、肺癌和结直肠癌等晚期实体瘤。
5.百暨基因CLL-1 CAR-T报IND。百暨基因自体抗CLL-1嵌合抗原受体T细胞注射液的临床试验申请获CDE受理。CLL-1是极具药物开发潜力的靶点之一,它通常高表达在儿童急性髓系白血病(AML)细胞和白血病干细胞LSCs上。ASCO2021年会上的一项临床数据显示,该新药在AML患者中达到82%的缓解率(ORR),完全缓解率(CR)达到73%。临床中,患者仅有1-2级细胞因子释放综合征,没有明显的神经毒性综合症。
6.普众发现CDH6-ADC海外授权。昂阔医药与普众发现就后者临床前期的CDH6靶向抗体药物偶联物(ADC)AMT-707(CUSP06)达成合作许可协议。在临床前研究中,CUSP06已在几种CDH6高表达和低表达的体内癌症模型中显示出良好的抗肿瘤活性。根据协议,普众发现将获得预付款,开发、注册和销售里程碑潜在付款以及分级特许权使用费;昂阔医药获得在大中华区以外的全球范围内独家开发和商业化CUSP06的权利。
国际药讯
1.全球首个CD20/CD3双抗获批上市。欧盟委员会有条件批准罗氏CD20/CD3 T细胞衔接双特异性抗体Lunsumio(mosunetuzumab)上市,用于治疗至少两种前期系统治疗的复发/难治性滤泡性淋巴瘤。这是全球首个CD20/CD3双抗获批上市,为这类患者提供一种无化疗、现货型的新免疫治疗选择。在一项Ⅰ/Ⅱ期临床GO2978中,中位随访为18.3个月时,中位缓解持续时间为22.8个月,完全缓解率为60%,客观缓解率为80%。
2.Veru新冠口服药向FDA报EUA。Veru公司宣布,已向FDA提交口服微管蛋白抑制剂sabizabulin(bisindole)的紧急使用授权申请(EUA),用于治疗中重度新冠住院患者。今年4月,Sabizabulin已在III期临床中获得积极结果,将患者的死亡风险相对降低55%(死亡率:45%vs20%,p=0.0029);而且口服Sabizabulin的耐受性良好。除新冠外,该药还被开发用于治疗去势抵抗前列腺癌、三阴性乳腺癌等。
3.罗氟司特泡沫剂脂溢性皮炎III期临床成功。Arcutis公司罗氟司特外用泡沫配方ARQ-154用于治疗中重度脂溢性皮炎的关键III期STRATUM研究达主要终点。与接受空白基质治疗相比,ARQ-154治疗达到IGA评分(皮肤症状“全部清除”或“几乎全部清除”以及较基线至少提高2级)的患者比例显著更高(80.1%vs59.2%,P<0.0001)。在包括瘙痒、脱屑和发红(红斑)等关键次要终点也具有显著改善。ARQ-154总体耐受性良好。
4.FIC干眼症疗法Ⅲ期临床成功。Aldeyra公司潜在“first-in-class”的小分子RASP抑制剂reproxalap,在治疗干眼症的Ⅲ期临床试验TRANQUILITY-2中达到主要终点。reproxalap旨在通过降低RASP(促炎性活性醛类物质)水平以达到抑制炎症缓解症状的作用。试验结果显示,接受一天给药后,reproxalap在Schirmer测试结果和≥10mm Schirmer测试应答者比例上均显著优于载体。Aldeyra计划在近期向FDA递交新药申请。
5.现货型CAR-T淋巴瘤临床积极。Precision BioSciences公司基于ARCUS基因编辑的同种异体CAR-T疗法PBCAR0191,在治疗弥漫性大B细胞淋巴瘤((DLBCL)经治患者的临床试验中获积极结果。最新数据显示,在11例接受自体CAR-T治疗后复发的患者中,该药达到100%的客观缓解率和73%的完全缓解率。在可评估缓解持续时间的6例患者中,3例患者的缓解持续时间超过6个月。
6.APOL1靶向疗法获FDA突破性疗法认定。FDA授予Vertex公司APOL1抑制剂inaxaplin(VX-147)突破性疗法认定,用于治疗APOL1介导的局灶节段性肾小球硬化患者。在一项Ⅱ期临床中,inaxaplin联合标准治疗显著降低患者的尿蛋白/肌酐比值,治疗13周后平均降幅为47.6%(95% CI:-60.0%,-31.3%)。欧盟药品管理局也于近期授予该疗法PRIME药品认定,用于治疗APOL1介导的慢性肾病。
医药热点
1.美国新冠再感染病例数超160万。美国广播公司8日报道,根据对美国多州提供数据的分析和汇编,全美24个州已报告了160多万例新冠再感染病例。其中,纽约州、缅因州和加利福尼亚州分别报告了超过20万例新冠再感染病例。数据统计还显示,越来越多的人二次感染新冠病毒,有些人是三次、四次感染,有人甚至五次感染新冠病毒。
2.复旦大学位列香港认可医学资格名单。6月8日,香港特区政府卫生署署长根据《医生注册条例》公布第二批涵盖23项获特别注册委员会(委员会)认可医学资格的名单,当中包括上海复旦大学,是首次有内地大学列入名单之中。复旦大学获批的相关医学资格是内外全科医学士的6年制医学课程。第二批名单中,还包括来自澳洲、加拿大、南非、英国及美国等颁授医学资格的团体。
3.2021年全国医保事业发展统计公报发布。国家医保局日前发布《2021年全国医疗保障事业发展统计公报》。截至2021年底,全国基本医疗保险参保人数136297万人,参保率稳定在95%以上。2021年,全国基本医疗保险(含生育保险)基金总收入28727.58亿元,比上年增长15.6%;全国基本医疗保险(含生育保险)基金总支出24043.10亿元,比上年增长14.3%;全国基本医疗保险(含生育保险)基金当期结存4684.48亿元,累计结存36156.30亿元,其中,职工基本医疗保险个人账户累计结存11753.98亿元。
评审动态
1. CDE新药受理情况(06月09日)
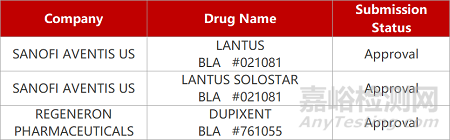
2. FDA新药获批情况(北美06月07日)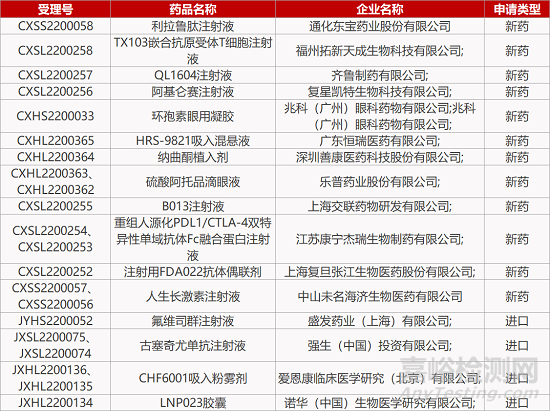

来源:药研发


