您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-29 21:48
01概述
新药研发就是一个从无到有的过程,过程费时、费力又耗钱财。那么新药研发大致是一个怎样的流程呢?下面我们就简单的介绍一下新药研发的基本过程。新药研发基本分为六大步,即:
①药物靶点确认及新化合物实体的发现;
②临床前研究;
③IND申请;
④临床试验;
⑤新药申请(NDA);
⑥上市及监测。
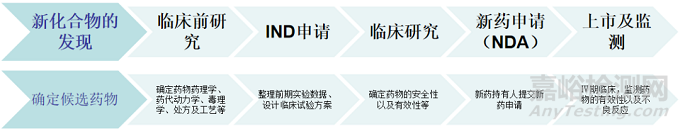
图1 新药研发大致流程(原创)
02药物靶点确认及新化物实体的发现
(1)药物靶点的发现
新药研发的首步就是药物靶点的确认。药物靶点是指药物在体内作用结合的位点,主要包括受体、酶、离子通道以及核酸等生物大分子。目前已经发现了药物靶点大概有500多个,其中受体蛋白是占绝大多数的。
以阿司匹林为例,在以前人们只知道阿司匹林具有消炎、止痛以及抗血栓等作用,直到1971年证明了阿司匹林的作用机理为抑制前列腺素合成。
理想的药物是安全的、有效的,并且对其靶标具有特异性,以便将副作用降至最低。
(2)新化合物实体的发现
新化合物实体也就叫先导化合物,是指各种途径和方法得到的具有某种生物活性和药理活性的化合物。一般有三种方式获得,第一种就是直接提取,在药物研发的早期阶段,从植物、动物或者微生物体内直接提取,这是一个非常重要的一个方式。例如,紫杉醇最早是从太平洋红豆杉中提取的,而一些疫苗、激素等提取自动物体内。也有从微生物代谢产物中提取的药物,例如洛伐他汀是从土霉素的发酵产物中分离出来的。
第二类是有机合成,主要包括化合物的分子设计、新化合物合成、化合物体外活性筛选以及疾病动物模型筛选。由于不是所有合成出来的化合物都有理想的活性,因此需要对这些化合物通过生物实验手段在细胞水平进行筛选,筛选出有活性的先导化合物。进而继续做特异性的疾病动物模型筛选。
第三类是分子改造,目前主要利用分子生物学、基因工程等技术将目标分子进行改造。
(3)活性化合物的筛选
围绕新的化合物我们会设计并合成大量的新化化物,通过构效关系的研究以及活性化物的筛选,最终得到活性更好的化合物。通过构效关系的研究,我们把满足基本生物活性的最优化合物作为我们后续研究的药物,也即为候选药物。
03临床前研究
(1)原料药研究
首先要进行原料药化学合成,因为需要提供足量的化合物进行临床前研究以及临床研究,每一步都要进行质量控制和验证。
由于原料药的一些理化性质会对后续制剂的研究造成一定的影响,例如原料的溶解度、渗透性、pH、pKa、晶型、油水分配系数以及粒径等,都可能会对制剂的吸收产生一定的影响。所以一般根据剂型特点以及给药途径,我们应重点研究一些重要的理化性质。例如,如果原料药的粒径对药物的溶解性以及体内吸收有影响,而我们又要开发固体口服制剂,那么我们就应该考察原料药对制剂相关性质的影响。此部分内容一般属于处方前开发的内容。
同时,我们也要研究原料药的一些生物学特性。例如原料药的ADME过程、毒副作用以及治疗窗等,这对后续的制剂开发都有很大的指导作用。例如,我们开发固体口服药物,但是经过原料药的研究后发现,原料的口服吸收较差,那么我们就可以通过选择合适的制剂技术来改善药物在体内的吸收,也可改剂型为注射剂。
(2)辅料研究
辅料可根据剂型及给药途径进行选择,选择辅料的首要原则就是不可与主要产生不良相互作用,而且在不影响制剂质量的前提下,所用的辅料种类应能少则少。
对于辅料的研究,我们前期可以通过调研了解其相互作用以及最大用量的情况。如果没有相关数据,那么我们可以通过原辅料相容性研究进行研究,具体研究方法可参考《Drug-Excipient compatibility studies: First step for dosage form development》、《化学药物制剂研究基本技术指导原则》、《ICH 指导原则 Q8(R2)》以及《Chemistry Review of Question-based Review (QbR) Submissions》。
(3)处方研究
处方研究是制剂研究的主要组成部分,根据对辅料的研究、剂型特点以及临床需求,我们应对处方进行初步的设计,初步拟定几个较为合理的处方进行后续研究,进而进行筛选。此过程中,一定要多设计几种合理的处方,确保经过层层选拔后,还有处方可用于后续研究。
制剂开发是新药研发流程中一个重要的环节,早期的制剂开发方便临床给药即可。随着项目的推荐,逐渐优化制剂的处方以及制备工艺。
(4)工艺研究
工艺研究也是制剂研究的重点,一般与处方研究同步进行逐渐的优化。工艺研究是产品商业化的重点,只有稳定的工艺,才可以确保产品可以稳定、高质量的被放大生产。工艺研究一把包含三部分,一般为工艺设计、工艺研究以及工艺放大。
我们可以根据剂型的特点、原料以及辅料的特点对工艺进行设计。例如,如果研发的药物存在多晶型,不同晶型可能影响药物的吸收,并且粉碎以及制粒等步骤对药物晶型产生影响,那么我们应避免药物晶型在工艺过程的变化。对于晶型的研究可以参考以下指导原则:《ICH指导原则:Q6A》、《2020版中国药典》、《化学仿制药晶型研究技术指导原则(征求意见稿)》以及《境外已上市境内未上市化学药品药学研究与评价技术要求(试行)》。还有的药物可能对湿热敏感,那么应避免使用湿法制粒,可采用干法制粒或粉末直压。所有的研究都应确保操作是可用于放大的,而不是只在小试阶段可操作,这样是无意义的,因为我们最终的目的就是由小试走向放大。
(5)包装材料选择
包材也是较为重要的一部分,因为合适的包材可以更大程度上保持产品的稳定性,延长产品货架期。对于包材的选择,我们一般遵循以下几点:①包材应保证制剂在一定期限内保持稳定;②包材与产品无相容性问题;③包材应与制剂工艺相匹配,例如静脉注射液包材需要满足湿热灭菌或辐射灭菌要求;④对定量给药的装置,应保证定量给药的准确性和重现性。详细内容可参见《化学药物制剂研究基本技术指导原则》第六部分。
(6)毒理学研究
主要包括急性毒性研究、亚急性和慢性毒性研究。急性毒性研究主要用来确定不产生毒性的最大剂量。亚急性和慢性毒性研究主要研究致癌性研究、生殖毒性研究、致畸性研究等。需要确定该化合物是否能够引起基因突变或线粒体DNA的损伤。
04 IND申请
在完成前两个阶段以后,就进入到了研究新药申请,也就是IND阶段,假如我们准备在中国申请,则需要准备临床研究方案并提交CFDA审核。主要内容就是对前期数据的一个整理以及对后期临床试验方案的一个设计。
05临床试验
(1)各期临床试验
项目进入到这一阶段,意味着前期发现的化合物终于可以用到人身体上进行试验。一般临床试验阶段分为一期、二期、三期以及对市场进行监测的四期临床。以下为临床试验的一些数据,包括一般需要的病例数以及所需时间等。
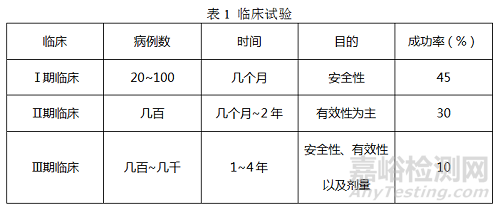
一般而言,进入到临床试验阶段呢,平均20个候选药物中,最终才只有一个能够被批准上市,所以这个比例还是比较低的。

图2 各期临床目的(原创)
(2)Ⅰ期临床
对于Ⅰ期临床的试验申请,申请者应按资料格式提交资料,应包含介绍性说明和总体研究计划、研究者手册、临床试验方案、药学研究信息以及药理毒理信息等内容。在早期的临床设计中,务必将研究受试者的保护视为第一任务。
研究者手册主要是对药物已有的药学以及非临床数据进行总结,旨在提供所有药物信息,保证受试者安全。研究者手册一般包含:①药物的基本信息,如药物的名称、结构、适应症以及药理特性等;②药物的非临床研究结果,如药物的药理作用、毒理研究以及非临床药代动力学研究等内容。
临床试验方案应包括以下信息:①研究背景,简述药物的适应症以及已有的有效性及安全性资料;②试验目的;③受试者的大概数量;④入选标准以及排除标准;⑤给药计划,包括持续时间、起始剂量、剂量递增方案及终止条件、给药方案描述首剂量确定依据和方法;⑥检测指标以及对受试者安全性评价;⑦终止研究的毒性判定原则和试验暂停标准,以确保受试者的安全。
药学研究目的就是保护受试者的安全,在此环节我们应该重点验证以下几点:①新药及辅料是否存在已知毒性或潜在毒性;②试验期间,药物能否确保稳定性,所以临床试验之前,我们一般需要提交加速6月的稳定性数据;③新药的杂质是否具有潜在毒性;④是否存在动物源性成分的生物安全性问题。申请人应根据已有的药学信息,分析是否存在潜在的人体风险。
对于毒理学的研究信息,应包括非临床研究综述、药理作用总结报告、毒理作用总结报告以及药代动力学总结报告。
对于此部分内容,详细可参见《新药Ⅰ期临床试验申请技术指南》以及《E8(R1):临床研究的一般考虑》。
(3)各期临床研究目的
下表为对临床研究的类型按研究目的进行分类:
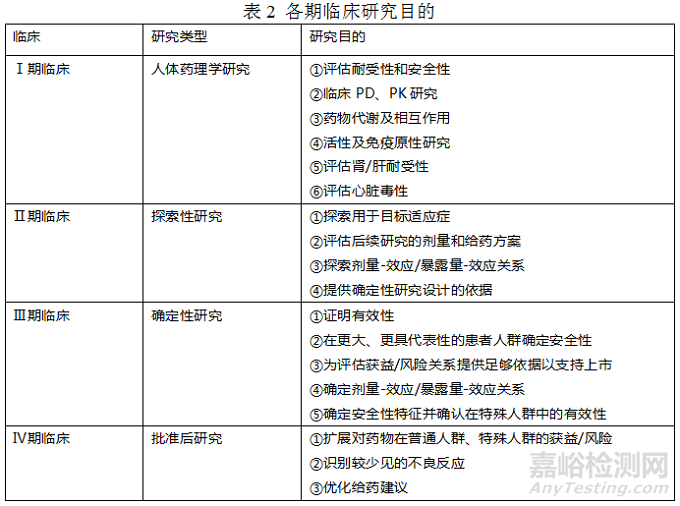
关于临床试验相关内容的了解可参见:《Phase I IND Guidance》、《Phase 2-3 IND Guidance》、《新药Ⅰ期临床试验申请技术指南》以及《E8(R1):临床研究的一般考虑》。
06新药申请(NDA)
完成上述3期临床后,新药持有人就可以提交新药申请(以申请CFDA为例),这个部分包括以下环节:
①申请的接受;
②CFDA审核;
③工厂检查(GMP认证);
④CFDA决定是否批准上市。
07上市以及监测
这部分主要是对药物上市以后的监测,主要关注药物在大范围使用以后,它的疗效以及对不良反应进行监测。该阶段还涉及到如药物配伍使用的研究、药物使用禁忌等。如果批准上市的药物在这一阶段呢被发现之前研究没有发现的一些严重的不良反应,该药物就会被监管部门强制要求下架。有的药物甚至上市只有一年时间,由于四期临床评价不好,会被迫下架。例如沙利度胺,上市后发现其导致婴儿海豹肢畸形,所以沙利度胺被禁止使用。
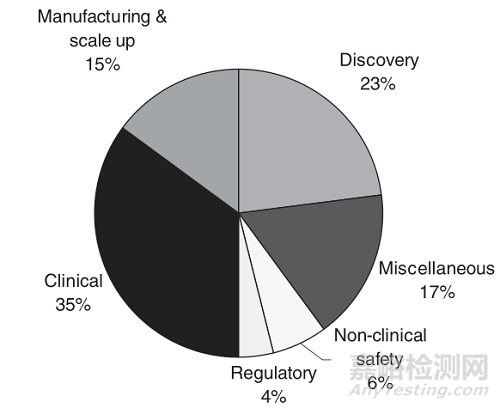
图3 各阶段研发费用占比(引自参考文献1)
上面我们简单介绍了新药研发的基本过程。我们可以看到,从最初靶点发现到新药上市,整个新药研发平均需要12~15年,而费用也是动辄十几亿美元。所以每个成功上市新药背后都投入了大量的人力、资金和时间,每个新药都来之不易。
参考文献:
[1] Keegan K D . The Drug Development Process[M]. John Wiley & Sons Ltd, 2013.
[2]《化学药物制剂研究基本技术指导原则》
[3]《ICH 指导原则 Q8(R2)》
[4]《Phase I IND Guidance》
[5]《Phase 2-3 IND Guidance》
[6]《新药Ⅰ期临床试验申请技术指南》
[7]《E8(R1):临床研究的一般考虑》

来源:药事纵横


