您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-18 11:10
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
国内药讯
国际药讯
1.赛诺菲CD38骨髓瘤Ⅲ期临床积极。赛诺菲CD38抗体Sarclisa(isatuximab)与卡非佐米和地塞米松(Kd)标准治疗联用,治疗先前接受过1-3次抗骨髓瘤治疗的复发/多发性骨髓瘤(MM)的Ⅲ期临床IKEMA最新结果积极。根据FDA关于删失规则的建议(适用于经批准的美国处方信息)进行的一项PFS分析显示,Kd治疗组mPFS为20.8个月,Sarclisa+Kd治疗组的mPFS为41.7个月(HR=0.59;95%CI:27.1-不可计算[NC]);研究期间未观察到新的安全性信号。
2.阿斯利康哮喘复方Ⅲ期临床积极。阿斯利康与Avillion开发的吸入式固定剂量组合PT027(沙丁胺醇/布地奈德)在治疗中重度哮喘的III期临床MANDALA中获积极结果。与沙丁胺醇抢救相比,PT027(沙丁胺醇/布地奈德,180/160mcg)使患者哮喘严重恶化的风险显著降低27%(p<0.001);使平均年化系统性皮质类固醇暴露总量减少33%(p=0.002),使年化严重恶化减少24%(p=0.008)。详细结果已公布在ATS2022会议上。
3.BI新型PDE4B抑制剂IPF临床积极。勃林格殷格翰口服PDE4B抑制剂BI 1015550治疗特发性肺纤维化(IPF)的Ⅱ期临床数据公布在《新英格兰医学杂志》(NEJM)和ATS20222大会上。12周治疗数据显示,BI 1015550治疗组患者的肺活量FVC中位值变化显示出轻微改善,安慰剂组患者的FVC则出现下降。在延缓IPF患者肺功能下降速度方面,BI 1015550优于安慰剂的概率超过98%。临床中未发现新的安全事件。
4.创新肾病疗法获FDA优先审评资格。FDA授予Travere公司内皮素/血管紧张素受体拮抗剂(DEARA)sparsentan新药申请优先审评资格,用于治疗IgA肾病。在一项Ⅲ期临床中,在治疗36周后,sparsentan组(n=280)蛋白尿较基线平均减少49.8%,活性对照组平均减少15.1%(p<0.0001)。如果获批,sparsentan将成为FDA批准用于IgA肾病的首个非免疫抑制疗法。
5.Opdivo+Yervoy组合尿路上皮癌临床失败。百时美施贵PD-1抑制剂Opdivo与CTLA-4单抗Yervoy联用,在一线治疗不可切除或转移性尿路上皮癌的Ⅲ期CheckMate -901试验未达到主要终点。与标准化疗相比,Opdivo+Yervoy组合未能显著改善肿瘤细胞表达PD-L1≥1%的患者的总生存期(OS)。目前该项试验还在评估Opdivo+Yervoy对不符合顺铂化疗条件的不可切除或转移性尿路上皮癌患者的治疗;以及评估Opdivo联合化疗与单独化疗对符合顺铂化疗条件的患者的影响。
6.基因疗法公司Kriya完成C轮融资。Kriya公司完成2.7亿美元的C轮融资,拟用于继续推进研发管线项目进入临床,并进一步扩展工程化、制造和计算平台。Kriya公司已构建开发潜在“best-in-class”基因疗法的生态系统,独有的计算引擎SIRVE能够整合该公司工程化和高通量筛选平台产生的大量数据,支持机器学习赋能的分析和智能产品设计。研发管线中包括拟用于1型和2型糖尿病的基因疗法KT-A112、拟用于2型糖尿病和肥胖症的GLP-1激动剂KT-A522等。
医药热点
1.上海全市社会面清零。5月17日上午举行的上海市疫情防控工作新闻发布会上,市卫健委副主任赵丹丹介绍:5月16日,上海市新增77例新冠肺炎本土确诊病例和746例本土无症状感染者。77例本土确诊病例中,31例在闭环隔离管控中发现,46例为无症状感染者转归确诊病例。746例本土无症状感染者均在闭环隔离管控中发现。目前,上海市16个区都已实现社会面清零。
2.我国首次出现奥密克戎BA.2.12.1变异株。《中国疾病预防控制中心周报(英文)》5月16日报告了我国首例确诊感染新冠病毒“奥密克戎”亚型毒株“BA.2.12.1”的境外输入病例的具体情况。2022年4月23日,从肯尼亚内罗毕抵达广东省广州的一位27岁旅客,于4月27日报告新冠病毒核酸阳性。4月30日,基因分型结果显示患者感染了奥密克戎亚型毒株BA.2.12.1。与其他奥密克戎亚型毒株相比,BA.2.12.1亚型具有更强的免疫逃逸能力。
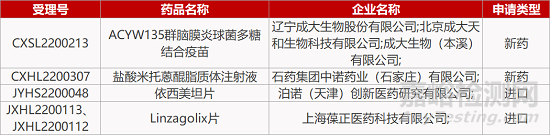
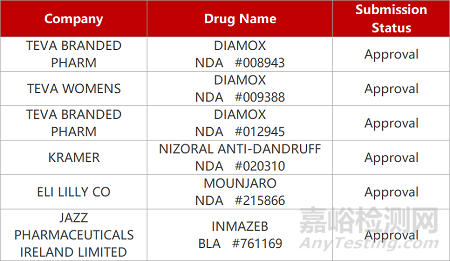
评审动态

来源:药研发


