您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-18 02:33
摘要
近年来,临床上多重耐药革兰阴性菌引起感染的死亡率居高不下。β⁃内酰胺酶是革兰阴性菌对多种β⁃内酰胺类抗生素耐药的主要原因。目前,治疗耐药革兰阴性菌感染的抗菌药物研发遭遇瓶颈,21世纪以来未见基于新靶点的小分子药物上市。近年来,新药研发机构逐渐聚焦于开发β⁃内酰胺酶抑制剂,旨在通过克服β⁃内酰胺酶介导的耐药性提高现有抗菌药物的临床疗效。头孢他啶⁃阿维巴坦在临床上的成功应用,使β⁃内酰胺类抗生素/ β⁃内酰胺酶抑制剂复方制剂成为最有望解决临床多重耐药革兰阴性菌感染的策略。
本文对近年来有关β⁃内酰胺类抗生素/ β⁃内酰胺酶抑制剂复方制剂的相关研究和临床应用进展进行综述,并对未来β⁃内酰胺酶抑制剂复方制剂的研究方向进行了展望。
关键词
β⁃内酰胺酶;β⁃内酰胺酶抑制剂;阿维巴坦;氨曲南;美罗培南
正文
抗生素耐药问题日趋严重,多年来未见针对新靶点的抗菌药物上市。临床上多药耐药的革兰阴性菌多感染免疫力低下的患者,引发难以治愈的重症感染。β⁃内酰胺类抗生素作为最主要的一类抗菌药,在过去的70 年内因其抗菌效果好、选择性强、高效低毒等特点,已得到广泛使用[1] 。但随着这类抗生素在临床上的广泛使用,细菌在面对长期生存压力下已经进化出了多种耐药机制,其中β⁃内酰胺酶的产生是目前革兰阴性菌最主要的耐药机制[2 -3] 。而β⁃内酰胺酶抑制剂能够抑制β⁃内酰胺酶与小分子β⁃内酰胺类抗生素的结合,从而恢复耐药细菌对小分子抗生素的敏感性,以达到抗菌的作用。
将小分子抗生素与β⁃内酰胺酶抑制剂联用成为复方制剂是解决耐药菌感染的重要手段。然而随着细菌耐药性的发展,一些原有的β⁃内酰胺类抗生素/ β⁃内酰胺酶抑制剂复方制剂已经失去了对产超广谱β⁃内酰胺酶( extended⁃spectrum β⁃lactamase, ESBL)、碳青霉烯酶等的革兰阴性菌的疗效,新型酶抑制剂复方制剂研发迫在眉睫。2015 年,头孢他啶⁃阿维巴坦(avibactam,商品名:Avycaz)获得美国FDA 批准,打破了数十年来没有新型结构的β⁃内酰胺酶抑制剂上市的局面。近年来,系列新型β⁃内酰胺酶抑制剂复方制剂上市,如雷利巴坦⁃亚胺培南⁃西司他汀和美罗培南⁃法硼巴坦,其抗菌效果好,能够抑制包括产超广谱β⁃内酰胺酶、碳青霉烯酶在内的多种β⁃内酰胺酶,有望解决碳青霉烯类抗菌药物的耐药问题,并将成为治愈多药耐药革兰阴性菌感染的新手段。本文将对系列新型β⁃内酰胺酶抑制剂及其与β⁃内酰胺类抗生素联用的复方制剂展开综述。
1、β⁃内酰胺酶及其分型
β⁃内酰胺酶是耐药菌产生的可催化水解青霉素、头孢菌素等β⁃内酰胺类抗生素分子中内酰胺键的一类失活酶,目前已超过4 900 种,可根据其分子结构或功能进行分类(见表1)。
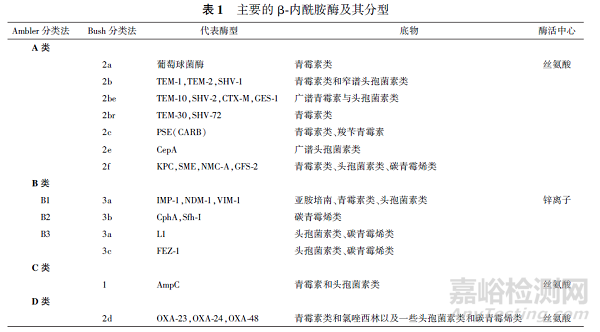
Ambler 分类法[4] 即分子生物学分类法,其根据分子结构即末端氨基酸同源性,将β⁃内酰胺酶分为A 类、B 类、C 类和D 类。其中A 类、C 类和D 类酶活性位点含有丝氨酸残基,故称作丝氨酸β⁃内酰胺酶(serine⁃β⁃lactamases, SBLs);而B 类酶需要Zn2 +或者其他重金属离子来发挥催化活性,因此称作金属β⁃内酰胺酶(metallo⁃β⁃lactamases, MBLs)。其中MBL 的产生会导致临床上除氨曲南以外的抗生素失效,共产SBL 与MBL 的革兰阴性菌将加剧临床上无药可用的局面。
Bush 分类法[5] 即功能分类法,是指Bush 等按照酶的底物水解特异性以及其是否能被克拉维酸(clavulanic acid) 或他唑巴坦及乙二胺四乙酸(EDTA) 所抑制,将β⁃内酰胺酶分为1 类、2 类、3类,其中1 类为头孢菌素酶,2 类为SBL,3 类为MBL。根据底物特异性,又可分为:广谱酶、超广谱β⁃内酰胺酶、青霉素酶、头孢菌素酶和碳青霉烯酶。
2、β⁃内酰胺酶抑制剂的发展
至今已上市的β⁃内酰胺酶抑制剂有克拉维酸、舒巴坦(sulbactam)、他唑巴坦(tazobactam)、阿维巴坦和法硼巴坦(vaborbactam)共5 种,均为SBL,而MBL 至今仍未见有效酶抑制剂药物批准上市。目前进入临床研究的新型SBL 抑制剂有2 类,一类具有三乙烯二胺类(diazabicyclooctanes, DBOs) 母核,以阿维巴坦为代表;另一类为硼酸化合物,以法硼巴坦为代表。这2 类新型化合物与传统的酶抑制剂相比,对临床上近年来出现的头孢菌素酶、碳青霉烯酶更加稳定,具有更为广泛的酶抑制谱,在治疗多药耐药的革兰阴性菌感染的应用上具有非常广阔的发展前景。
2. 1 SBL 抑制剂
目前已经在临床上得到广泛使用的经典β⁃内酰胺酶抑制剂是克拉维酸、舒巴坦和他唑巴坦。克拉维酸[6] 是棒状链霉菌的次级代谢产物,故又名棒酸,作为第一个β⁃内酰胺酶抑制剂,其发现具有里程碑式的意义。而舒巴坦[7] 和他唑巴坦[8] 是分别于1978 年和1984 年发现的青霉烷砜类半合成β⁃内酰胺酶抑制剂,其中舒巴坦对不动杆菌属具有中等内在活性。这3 类酶抑制剂仅能抑制部分A 类β⁃内酰胺酶,如青霉素酶与广谱β⁃内酰胺酶,而对头孢菌素酶、碳青霉烯酶以及B 类金属酶无效,酶抑制作用非常有限。
可逆的β⁃内酰胺酶抑制作用让阿维巴坦成为有别于经典酶抑制剂的新型β⁃内酰胺酶抑制剂。传统酶抑制剂与β⁃内酰胺酶形成Michaelis 复合体后,β⁃内酰胺酶丝氨酸亲核进攻酰胺键,抑制剂发生开环使酶失活,但其自身结构被破坏,故称为“自杀式抗菌药物”;而当β⁃内酰胺酶丝氨酸亲和进攻阿维巴坦的酰胺键后,将形成开环的共价结合物,此结合物中的阿维巴坦不发生水解,再经环合形成内酰胺环后可再次得到阿维巴坦,在此过程中阿维巴坦自身结构经可逆反应恢复,从而发挥更长效的酶抑制作用。阿维巴坦在体外可抑制A 类、C 类和某些D 类β⁃内酰胺酶(OXA⁃48 型酶),但对OXA⁃23 型酶以及OXA⁃24/40 型酶无效。法硼巴坦与阿维巴坦DBO 的母核结构不同,是第一个基于环硼酸药效团的新型β⁃内酰胺酶抑制剂,在抗菌谱、药物代谢和临床疗效等方面均具有良好的特性,在体外可抑制A 类、C 类β⁃内酰胺酶,对碳青霉烯酶,特别是肺炎克雷伯菌碳青霉烯酶(KPC)具有良好活性。
2. 2 MBL 抑制剂
金属β⁃内酰胺酶可以水解除单环β⁃内酰胺类抗生素之外的几乎所有β⁃内酰胺类抗生素,目前尚无有效的抑制剂上市。报道称金属螯合剂、二氮菲和吡啶二羧酸对所有金属β⁃内酰胺酶有抑制作用,然而它们在临床上却没有很大意义。临床有效的金属酶抑制剂必须在满足对各种MBLs 或同种类型MBLs 起作用的同时,对人体金属酶如血管紧张素转化酶(angiotensin converting enzyme,ACE) 无害。
近年来,文献已报道若干从天然产物或合成化合物中筛选得到的MBL 抑制剂,如2,3⁃二乙基马来酸二钠(ME1071)、天然产物曲霉明素A、1,4,7⁃三氮杂环壬烷⁃1,4,7⁃三乙酸(NOTA)、1,4,7,10⁃四氮杂环十二烷⁃1,4,7,10⁃四乙酸(DOTA) 等。其通过与MBL 活性部位锌原子的螯合而起到抑制作用,它们对哺乳动物含锌酶的抑制将不可避免,因此导致对血管紧张素转化酶、乙醇脱氢酶及哺乳动物羧肽酶的明显抑制。因为活性或选择性问题,它们能否最终应用于临床有待进一步研究。
3、β⁃内酰胺酶抑制剂复方制剂
联合用药是解决耐药性发展的最可靠的策略之一,自2010 年以来,已有大量新的组合进入临床开发阶段,β⁃内酰胺类/ β⁃内酰胺酶抑制剂复方制剂已经在临床上取得了成功(见表2)。
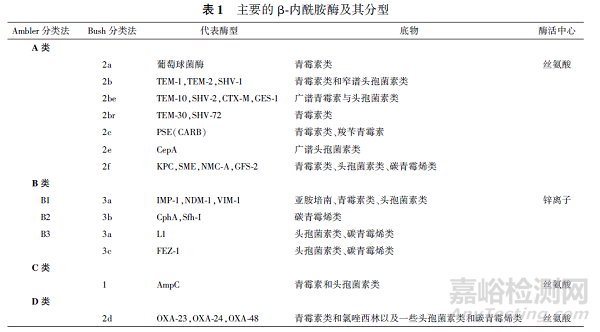
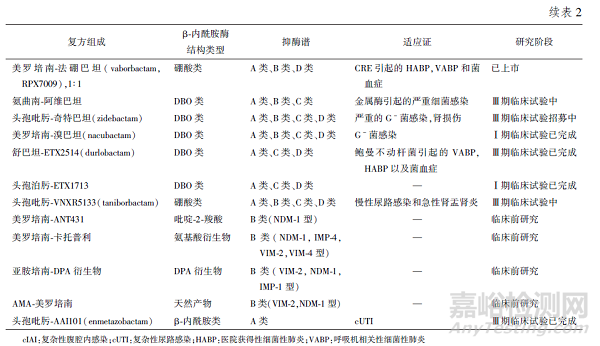
目前临床上可用的β⁃内酰胺酶抑制剂按母核结构可分为:β⁃内酰胺类、DBO 类及硼酸类。β⁃内酰胺类的β⁃内酰胺酶抑制剂复方制剂仅能够抑制A 类酶,而DBO 类及硼酸类酶抑制剂复方制剂能够抑制A 类、C 类及D 类酶(SBL)发挥超广谱的β⁃内酰酶抑制作用,部分复方对产MBL 的菌株具有抗菌活性。
3. 1 抑制SBL 的复方制剂
抑制SBL 的复方制剂主要分为β⁃内酰胺类的酶抑制剂复方和三乙烯二胺类酶抑制剂复方两大类。本部分将介绍2 种新型β⁃内酰胺类的酶抑制剂复方,一种是新型抗生素ceftolozane 与经典酶抑制剂他唑巴坦联用后组成的复方,另一种是头孢吡肟与新型β⁃内酰胺酶抑制剂AAI101 组成的复方。三乙烯二胺类抑制剂复方主要包括头孢他啶⁃阿维巴坦和亚胺培南⁃西司他丁⁃雷利巴坦。
3. 1. 1 ceftolozane⁃他唑巴坦
ceftolozane⁃他唑巴坦(商品名:Zerbaxa)于2014 年12 月获美国FDA 批准用于治疗成人复杂性腹腔内感染(cIAI)和包括急性肾盂肾炎(acute pyelonephritis,AP)在内的复杂性尿路感染(cUTI)[9] ,该复方还被批准用于治疗成人的HABP 和VABP[10] 。ceftolozane 是一种新型的第5代头孢菌素类药物,和他唑巴坦联用时,具有强效抗铜绿假单胞菌活性,对源自铜绿假单胞菌的C 类头孢菌素酶(class C pseudomonas derived cephalosporinase, PDC)很稳定。但本品对耐碳青霉烯类的肠杆菌科细菌( carbapenem⁃resistant enterobacteriaceae, CRE)、鲍曼不动杆菌以及嗜麦芽窄食单胞菌无效。Popejoy 等[11] 经综合分析后指出,ceftolozane⁃他唑巴坦对产ESBL 的肠杆菌科细菌引起的cIAI 和cUTI 具有较高的临床治愈率。2 项在日本开展的临床试验[12 -13] 表明,该复方是治疗大肠埃希菌和肺炎克雷伯菌引起的无并发症的AP,cUTI 以及cIAI的有效方法。一项多中心非劣效性临床试验结果表明,ceftolozane⁃他唑巴坦治疗由革兰阴性菌引起的医院获得性肺炎的疗效和安全性不劣于美罗培南[14] 。
3.1.2 头孢吡肟⁃enmetazobactam(AAI101)
AAI101的Ⅲ期临床研究(NCT⁃03687255) 已完成,适应证为cUTI。AAI101 是由他唑巴坦结构改造而成的新型β⁃内酰胺酶抑制剂,酶抑制谱相对他唑巴坦更为广泛,如可以抑制他唑巴坦不能抑制的肺炎克雷伯菌碳青霉烯酶。该组合对产A 类ESBL 的肠杆菌科细菌有效[15] ,可作为碳青霉烯类抗菌药物的替代治疗选择。AAI101 可以抑制A 类β⁃内酰胺酶包括KPC 型酶,半数抑制浓度(IC50 )≤0. 52 μmol·L-1,对A 类酶抑制作用强于他唑巴坦。在由耐头孢吡肟的肠杆菌科细菌引起的粒细胞减少小鼠大腿感染模型[16] 和小鼠脓毒血症模型[17] 中,该复方显著降低了细菌载量。Ⅲ期临床研究结果正在接受Clini⁃calTrials. gov 网站质量控制(QC)审查,即将公布。
3. 1. 3 头孢他啶⁃阿维巴坦
头孢他啶⁃阿维巴坦(商品名:Avycaz)于2015 年2 月批准用于治疗cIAI和cUTI,并于2018 年1 月批准用于治疗HABP 和VABP[18] 。该复方对产KPC 型和OXA⁃48 型的肠杆菌科细菌具有很强的抗菌活性,对耐碳青霉烯类铜绿假单胞菌(CRPA)也有效,但其对鲍曼不动杆菌和嗜麦芽窄食单胞菌无效。Stone 等[19] 采用微量肉汤稀释法对7 729 株肠杆菌科细菌和2 053 株铜绿假单胞菌进行药敏试验,结果发现肠杆菌科细菌对头孢他啶⁃阿维巴坦的敏感率为99. 3%,其中CRE敏感率为89. 6%;而铜绿假单胞菌对该复方的敏感率为86. 6% ,其中多药耐药铜绿假单胞菌敏感率为61. 4% (除黏菌素为98. 9% 外,其他对照药物均<50% )。
相关临床研究结果表明,头孢他啶⁃阿维巴坦在治疗多药耐药的肠杆菌科细菌以及铜绿假单胞菌的疗效不亚于美罗培南。一项随机双盲的Ⅲ期临床研究结果表明,本品联合甲硝唑对cIAI 的临床治愈率不亚于美罗培南(分别为95. 7% 和92. 1%)[20] 。另一项Ⅲ期临床试验发现经本品治愈后的包括AP 在内的cUTI 患者的综合症状缓解和微生物反应率不次于多利培南(分别为71. 2%和64. 5%)[21] 。一项多中心的双盲临床试验发现,本品与美罗培南对感染包括肠杆菌科细菌、嗜血杆菌与铜绿假单胞菌等病原体的HABP 或VABP 住院患者的临床治愈率分别为67. 2%和69. 1%,提示本品可作为碳青霉烯类药物的替代治疗药物治疗HABP/ VABP。
3. 1. 4 亚胺培南⁃西司他丁(cilastatin)⁃雷利巴坦(relebactam)
本品(商品名:Recarbrio)于2019 年7 月被批准用于治疗cIAI 和cUTI,并于2020 年6月批准用于18 岁以上HABP 和VABP 患者的治疗[22] 。复方中的西司他丁是肾肽酶抑制剂,而雷利巴坦能够有效抑制KPC⁃2 型酶和头孢菌素酶(AmpC 酶)。本品对产A 类和C 类β⁃内酰胺酶的肠杆菌科细菌具有良好抗菌活性。在由铜绿假单胞菌和肠杆菌科细菌引起的粒细胞减少小鼠感染模型和小鼠肺感染模型[23] 以及在由亚胺培南耐药的铜绿假单胞菌引起的小鼠大腿感染模型中,该复方有效[24] 。RESTORE⁃IMI 1 Ⅲ期临床试验证明了在主要微生物治疗意向人群(mMITT)以及补充性微生物治疗意向人群(SmMITT)中,本品的有效性和安全性要优于亚胺培南⁃黏菌素[25] 。另一项在日本进行的有关cIAI 与cUTI 的Ⅲ期临床研究中,本品治疗后85. 7%(n =24/28) cIAI 患者和100. 0%(n =39/39) cUTI 患者获得良好的临床疗效[26] 。
3. 2 抑制MBL 的复方制剂
至今,临床上仍无可用的MBL 抑制剂。MBL抑制剂均处于临床前研究阶段,常与美罗培南或亚胺培南合用,共同发挥对产MBL 菌株的抗菌活性。但这些化合物能否进入临床研究阶段仍有待进一步研究。
3. 2. 1 美罗培南⁃ANT431
ANT431 是一种专门为抑制MBLs 而设计的新型吡啶⁃2⁃羧酸,对纯化后的NDM⁃1 和VIM⁃2 型酶的抑制活性以亚微摩尔计[27] ;与美罗培南合用时,对表达NDM⁃1 型酶的肠杆菌科细菌具有良好活性。在感染产NDM⁃1 型酶大肠杆菌的小鼠大腿感染模型中,该组合有效。因其MBL酶抑制谱有限,可能无法成为临床候选化合物,但该组合仍是有希望的新型MBL 抑制剂研发原型[28] 。
3. 2. 2 美罗培南⁃卡托普利(captopril)
卡托普利具有巯基和羧基结构,能以配位键结合金属离子,L⁃或D⁃卡托普利均对各类MBLs 有很强的抑制活性,其中D⁃卡托普利的抗菌活性最强。Ma 等[29] 发现L⁃卡托普利和EDTA 均能够抑制NDM⁃1 型酶对美罗培南的水解。Brem 等[30] 的研究表明,D⁃卡托普利能够增强美罗培南对多种MBLs 表达菌株(表达VIM⁃2, VIM⁃4, IMP⁃4, NDM⁃1 型酶的菌株) 的抗菌作用。近年来,已有研究以卡托普利为基础结构进行优化,得到了系列具有良好MBL 抑制活性的巯基丙酰胺衍生物。Meng 等[31] 设计了系列卡托普利衍生物,其NDM⁃1 型酶抑制活性显著增强,其中化合物14m[(2⁃((1H⁃吲哚⁃5⁃基)甲基)⁃3⁃巯基丙基)⁃L⁃苯丙氨酸] 与美罗培南具有协同抗菌活性,对产NDM⁃1 型菌株有效,该化合物水溶性良好、细胞毒性低、代谢稳定性高,具有较好的临床应用前景。
3.2.3 亚胺培南⁃吡啶二甲酸(dipicolinic acid, DPA)衍生物
DPA 的衍生物是一种新型的广谱MBL 抑制剂,对VIM⁃2,NDM⁃1 和IMP⁃1 型金属酶有效。Chen 等[32] 对DPA 进行结构优化和结构活性关系(SAR)分析,得到了抑制剂36,其对NDM⁃1 型酶的IC50仅为80 μmol·L-1,与目前文献中报道的最有效的NDM⁃1 型酶抑制剂水平相当;当化合物36 与亚胺培南合用时,能够将表达NDM⁃1 型酶的大肠杆菌和肺炎克雷伯菌的最小抑菌浓度(MIC)值降至敏感水平,且无哺乳动物细胞毒性。
3. 2. 4 曲霉明素A(aspergillomar⁃asmine A,AMA)⁃美罗培南
AMA 是通过细胞筛选技术获得的真菌Aspergillus versicolor 的天然产物。AMA 在体外和体内都能恢复美罗培南的抗菌活性。AMA⁃美罗培南能够抑制B1 类MBLs[33] ,如NMD⁃1 和VIM⁃2 型金属酶。King 等[34] 的研究发现,AMA 能够恢复美罗培南在体外对产MBL 的肠杆菌科细菌、鲍曼不动杆菌和铜绿假单胞菌的抗菌活性,与美罗培南合用后在小鼠系统性感染模型中对产NDM⁃1 型酶的肺炎克雷伯菌有效。
3. 3 抑制SBL 和MBL 的复方制剂
抑制SBL 和MBL 的复方制剂主要包括两大类:一类是三乙烯二胺类酶抑制剂复方,如氨曲南⁃阿维巴坦、头孢吡肟⁃奇特巴坦、美罗培南⁃溴巴坦、舒巴坦⁃ETX2514、头孢泊肟⁃ETX1713;另一类是硼酸类酶抑制剂复方,如美罗培南⁃法硼巴坦、头孢吡肟⁃VNXR5133。
3.3. 1 氨曲南(aztreonam)⁃阿维巴坦
本品用于治疗产MBL 革兰阴性菌引起的严重细菌感染,复方中氨曲南对MBL 稳定,但却易被许多其他β⁃内酰胺酶(如ESBL,AmpC 酶)水解。本品对MBL⁃肠杆菌科细菌有较强的抗菌活性,有望成为我国治疗MBL⁃肠杆菌科细菌感染的新候选药物。Zhang 等[35] 发现4 μg·mL-1阿维巴坦能使对氨曲南耐药的MBL⁃肠杆菌科细菌的MIC 降低8 倍以上。在由产金属酶的肠杆菌科细菌和铜绿假单胞菌引起的小鼠大腿感染模型中,该组合也能够降低细菌载量[36] 。Cornely等[37] 临床研究显示,氨曲南与阿维巴坦联用后,安全性与氨曲南已知的安全性一致,对cUTI 的总体临床治愈率为58.8%(20/34)。
3. 3. 2 头孢吡肟⁃奇特巴坦(zidebactam)
奇特巴坦是新型DBO 类化合物,具有强效青霉素结合蛋白(pencillin binding protein,PBP)⁃2 抑制活性,故本身即有内在抗菌活性,能够抑制产生SBL 和MBL 的肺炎克雷伯菌、铜绿假单胞菌和鲍曼不动杆菌[38] 。尽管对鲍曼不动杆菌的体外活性很低(MIC 为16 ~64 μg·mL-1),但与头孢吡肟联用后能够降低粒细胞减少小鼠大腿和肺感染模型中的细菌载量[39 -40] 。目前该复方已经完成一系列Ⅰ期临床试验(NCT02674347,NCT02707107, NCT02942810,NCT03630094)。
3. 3. 3 美罗培南⁃溴巴坦(nacubactam)
与奇特巴坦类似,溴巴坦也具有PBP⁃2 结合活性以及内在抗菌活性,是A 类和C 类β⁃内酰胺酶的有效抑制剂。该复方对产金属酶的肠杆菌科细菌具有抗菌活性[41] 。研究表明,在小鼠的cUTI 模型中溴巴坦单用即有显著的抗菌效果,与美罗培南联用后对产NDM, KPC, OXA, CTX⁃M, SHV, TEM 型酶菌株有效[42] ;在粒细胞减少的小鼠肺感染模型中,本品对表达A 类β⁃内酰胺酶的肠杆菌科细菌[43] 以及过表达AmpC 型酶并同时表达KPC 型酶的铜绿假单胞菌有效[44] 。本品已经完成Ⅰ 期临床试验(NCT03182504)。
3. 3. 4 舒巴坦(durlobactam)⁃ETX2514
舒巴坦是一种经典的β⁃内酰胺酶抑制剂,而ETX2514 由阿维巴坦结构改造而来,是一种能够抑制A 类、C 类和D类β⁃内酰胺酶的超广谱β⁃内酰胺酶抑制剂[45] ,因其能够抑制PBP⁃2 也具有内在抗菌活性。有研究表明,该组合对鲍曼不动杆菌的体外抗菌活性与黏菌素相当[46] ,其耐受性与安全性良好[47] ,是很有望成为治疗多药耐药鲍曼不动杆菌的候选药物。在体外ETX2514 能显著降低舒巴坦对碳青霉烯类耐药的鲍曼不动杆菌的MIC 值[45] ,而在体内该组合对多药耐药鲍曼不动杆菌引起的粒细胞减少的小鼠大腿和肺感染模型有效[48 -49] 。Ⅱ期临床研究表明,该复方在cUTI 患者中耐受性良好,未报告严重不良事件[50] 。Ⅲ期临床研究已于近期完成但结果尚未公布(NCT03894046)。
3. 3. 5 头孢泊肟(cefpodoxime)⁃ETX1713
头孢泊肟⁃ETX1713 是第一个通过Ⅰ期临床试验的新型口服BL⁃BLI 组合(NCT⁃03491748)[51] 。相关研究表明, ETX1713 不仅对大肠埃希菌的PBP⁃2 有选择性抑制活性,且对纯化后的A 类、C 类、D 类β⁃内酰胺酶也具有抑制活性,该抑制活性显著强于阿维巴坦(即IC50值更低)。该组合可降低产ESBL 大肠埃希菌和KPC⁃2 型酶肺炎克雷伯菌在小鼠尿路感染和大腿感染模型中的细菌载量。药动学(PK) / 药效学(PD)研究支持该组合作为一种有效的复方制剂以对抗产ESBL 和碳青霉烯酶的菌株[52] 。
3. 3. 6 美罗培南⁃法硼巴坦
2017 年8 月美罗培南⁃法硼巴坦(vaborbactam,商品名:Vabomere)经美国FDA 批准上市,用于治疗几种革兰阴性菌引起的包括AP 在内的成人cUTI[53] ,治疗由CRE 引起的HABP,VABP 和菌血症的Ⅲ期临床试验已完成,批准的适应证有望进一步扩大。法硼巴坦能抑制包括KPC 型酶在内的A 类和C 类β⁃内酰胺酶,其对B 类酶也表现出一定的抑制活性(IC50 = 136 ~ 631μmol·L-1 )[54] 。因鲍曼不动杆菌和铜绿假单胞菌具有药物外排能力,本品对其无效,但在这2 种细菌引起的小鼠大腿感染模型中,该组合能够降低细菌载量[55 -57] 。TANGO Ⅰ随机化临床试验表明,美罗培南⁃法硼巴坦治疗成人cUTI 与AP 的总体成功率与微生物根除率均优于哌拉西林⁃他唑巴坦[58] 。
TANGO Ⅱ临床试验表明,美罗培南⁃法硼巴坦单药治疗可提高CRE 感染的临床治愈率且死亡率和肾毒性有所降低[59] 。
3. 3. 7 头孢吡肟⁃VNXR5133 ( taniborbactam)
VNXR5133 是一种有效的A 类、B 类、C 类和D 类β⁃内酰胺酶抑制剂[60] ,可增强头孢吡肟对产KPC, VIM, NDM, ESBLs 和AmpCs 酶的肠杆菌科细菌的活性。本品对头孢他啶⁃阿维巴坦耐药的KPC⁃3 型突变体和对ceftolozane⁃他唑巴坦耐药的PDC 突变体有效。本品对由头孢菌素耐药肺炎克雷伯菌引起的粒细胞减少小鼠肺感染和由CRE(包括MBL 产生菌)引起的小鼠菌血症和粒细胞减少小鼠大腿感染均有效。目前,该组合正在进行慢性尿路感染和AP 治疗的Ⅲ期临床试验(clinicaltrials. gov identifier:NCT03840148),治疗由CRE 以及CRPA 引起的感染。
4、总结与展望
新型β⁃内酰胺类抗生素/ β⁃内酰胺酶抑制剂复方制剂将成为解决多药耐药革兰阴性菌感染的重要治疗手段,复方中酶抑制剂的种类主要为DBO 类和硼酸类[61] 。在新型的DBO 类β⁃内酰胺酶抑制剂中,阿维巴坦和雷利巴坦已经进入上市阶段,而广谱酶抑制剂ETX2514 与舒巴坦合用后还能对临床上耐药最为严重的鲍曼不动杆菌发挥强效抗菌活性,有望成为治愈多药耐药鲍曼不动杆菌感染的新药。奇特巴坦和溴巴坦是具有PBP⁃2 强效结合活性的SBL 抑制剂,虽然本身对MBL 无抑制作用,但分别与头孢吡肟和美罗培南合用后能够对产部分MBL的菌株发挥抗菌活性,但这种体外MBL 菌株的抗菌活性能否转化为体内活性仍需要更多的临床研究和探索。同时,这也提示我们筛选具有青霉素结合蛋白结合活性的新型β⁃内酰胺酶抑制剂或优化酶抑制的青霉素蛋白结合活性将有利于开发具有抗菌活性的新型酶抑制剂,并将成为新型酶抑制剂研发的方向。新型的硼酸类β⁃内酰胺酶抑制剂有法硼巴坦和VNXR5133,其中法硼巴坦已进入上市阶段,VNXR5133 等新型硼酸类化合物的出现为开发共同抑制SBL 和MBL 的酶抑制剂带来了希望。目前,仍然没有针对MBL 的抑制剂进入Ⅱ期或Ⅲ期临床研究阶段,MBL 抑制剂研发仍然面临巨大挑战。
参考文献
《中国新药杂志》2022 年第31 卷第4 期

来源:凡默谷


