您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-04-05 21:12
笔者在参考多篇学术文章后,决定再补充PF-07321332设计背后隐含的细节,方便大家更好的理解。
病毒常见靶点:蛋白酶
冠状病毒基因组在复制过程中,需要将polyprotein裂解为非结构蛋白,而将polyprotein裂解的过程是由3CL蛋白酶和PL蛋白酶完成的。由于3CL蛋白酶只切割谷氨酰胺(Gln)残基后的多肽,目前还没有已知的人类蛋白酶显示出与3CL蛋白酶相同的切割特异性,因此3CL蛋白酶作为SARS-CoV-2的潜力靶点受到极大关注。
病毒的蛋白酶是开发小分子抗病毒口服药物的常见靶点,其中最有代表性的药物当属HIV和HCV蛋白酶抑制剂。图1和图2列举了已上市的HIV和HCV蛋白酶抑制剂结构,其中的ritonavir(图1标红,用作CYP3A4抑制剂减缓PF-07321332的代谢分解)和boceprevir(图2标红,部分片段与PF-07321332相同)都与辉瑞的新冠药物有一定关联。
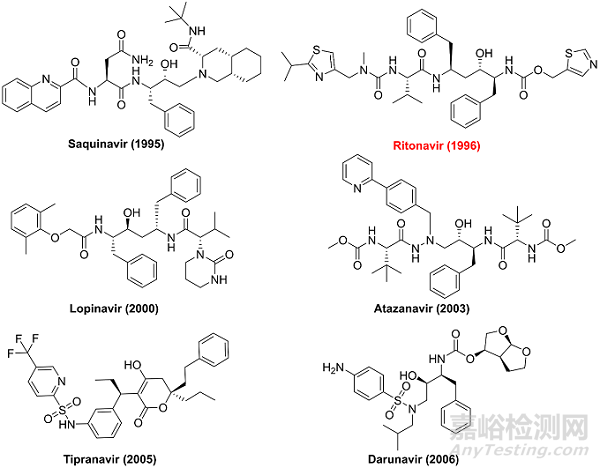
图1.部分FDA获批上市的HIV蛋白酶抑制剂的分子结构和相应的上市年份。

图2.FDA获批上市的HCV NS3/4A蛋白酶抑制剂的分子结构和相应的上市年份(由于后来有更好的治疗药物上市,都已停止生产)。
3CL蛋白酶,因其切割位点与picornavirus的3C蛋白酶很相似而得名。人鼻病毒(HRV)则是最常见的picornavirus。Rupintrivir是人鼻病毒(HRV)3C蛋白酶抑制剂(也是第一个进入临床的3C蛋白酶抑制剂),但由于II临床结果不理想而终止研发。之前的文章已经提到辉瑞在SARS期间在保留rupintrivir的Michael受体的基础上,优化得到活性很好的PF-00835231分子。而PF-00835231的优化过程,其实是和3CL蛋白酶的催化机理密切相关的。
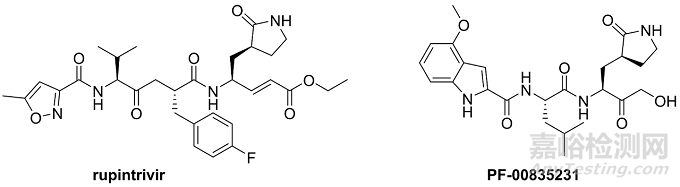
图3. Rupintrivir与辉瑞在SARS期间的发现的PF-00835231的分子结构。
特征催化机理和底物分析发现保守片段
3CL蛋白酶对底物水解的催化机理如图4所示,可以发现3CL蛋白酶的活性位点包含Cys145和His41,二者形成一个催化二联体,对识别底物起到关键作用。因此,通过模仿3CL蛋白酶的天然肽底物,引入特定的“共价弹头”( 如Michael受体、羰基和氰基等)与Cys145共价结合是很直接的思路。
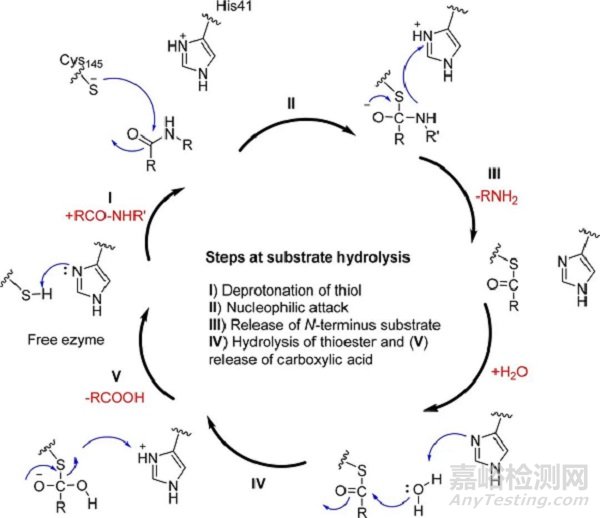
图4. SARS/SARS-CoV-2的3CL蛋白酶的底物水解机理。From:JMC 2016
通过对UniProt数据库中报道的pp1ab polyprotein序列进行分析,可以发现SARS和SARS-CoV-2的3CL蛋白酶的底物有特异性的P1(Gln,Q)和高度保守的P2位点(Leu,L)。P3、P4则分别以T/K/R/V和A/V/P/T为主。
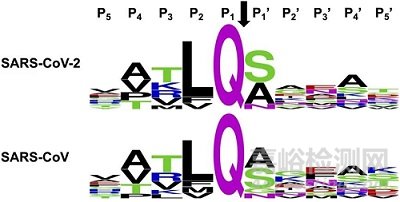
图5. SARS-CoV-2和SARS-CoV的3CL蛋白酶识别polyprotein的裂解位点,数据来源于UniProt数据库中报道的pp1ab polyprotein序列。From:Bioorganic & Medicinal ChemistryLetters 2020
如图6所示,2020年VincenzoSumma等人在JMC总结了3CL蛋白酶抑制剂的结构特征:P1和P2位点基本都参照Gln和Leu改造;P3/P4位点则一般是用来进行结构优化改善溶解性、渗透性和口服利用度等成药性;“共价弹头”则以羰基和Michael受体为主。
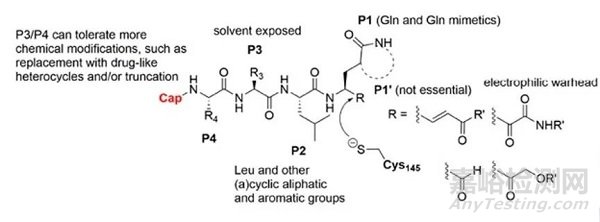
图6. SARS-CoV-2的3CL蛋白酶拟肽共价抑制剂的主要特征。From:JMC 2020
看到这里,其实就不难理解辉瑞的PF-00835231的优化过程,PF-00835231的P1/P2就是参考保守的Gln和Leu,而可调节的P3部分(吲哚环)有可能是参考了Trp的侧链设计的。
药化改造提高分子口服利用度
下面从3个具体的分子来分析3CL蛋白酶的设计思路,分别是四川大学杨胜勇老师团队设计的MI-09、MI-30和辉瑞的PF-07321332。可以明显的发现,杨老师团队和辉瑞的科学家都不约而同的在保守的P1和P2选择了环化的Gln和Leu(增强结构的刚性,减少结合时的构象熵,同时提高logP和渗透性);对于P3,一般是根据结合的口袋环境、同时改善渗透性和口服利用度来设计;而“共价弹头”则分别是选用了羰基和氰基。
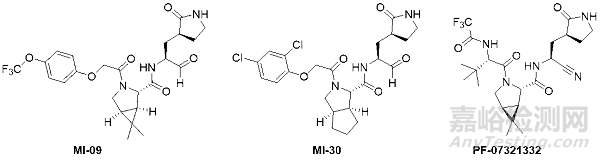
图7.四川大学杨胜勇老师团队设计的MI-09、MI-30和辉瑞的PF-07321332的分子结构。
具体的改造思路如图8所示,Gln一般是改造为γ-lactam,根据杨老师和辉瑞的引用文献,应该都有参考rupintrivir的γ-lactam片段。对于Leu,杨老师团队是根据共晶结构沿用了HCV的NS3/4A蛋白酶抑制剂boceprevir和telaprevir的P2片段;而辉瑞的分子也同样有boceprevir的P2片段。对于相对疏水的S3口袋(P3对应的3CL蛋白酶的口袋环境),两个团队都选择了相对疏水且都含有CF3的侧链(辉瑞的P3还有点类似底物保守残基Val)。
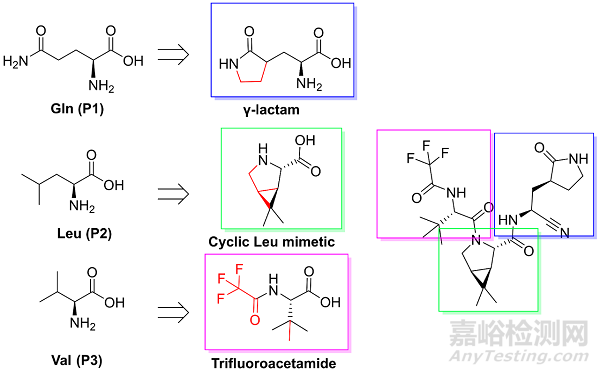
图8.辉瑞的PF-07321332的药化设计策略分析。
小结
本文探讨了PF-07321332设计的一些细节,背后主要是3CL蛋白酶的拟肽抑制剂的设计策略。
1、由于3CL蛋白酶特异性的催化机理,抑制剂的设计都会保留高度保守的P1(Gln)和P2(Leu);
2、从药化角度出发,Gln和Leu通常会被改造为环状,借鉴了感冒药rupintrivir的γ-lactam片段和HCV NS3/4A蛋白酶抑制剂的氮杂双环;
3、为了提高抑制剂的渗透性和口服利用度,一般要改造P3和“共价弹头”。
PF-07321332很大概率会很快上市,届时应该是3CL蛋白酶的首个上市分子。了解辉瑞的研发过程后,不难发现活性很好的分子其实早在SARS期间就被发现了,而且优化到PCC的过程并不算复杂,纵观小分子研发的速度,这绝对是神速了,但在新冠的背景下还是让人感觉不够快。最后,新冠口服药物的开发应该还会继续。纵观HIV和HCV的药物研发过程,由于病毒易出现耐药突变,“鸡尾酒疗法”(不同机制的药物联合用药)几乎是发展的必然趋势,相信与PF-07321332联合用药的临床实验也在提上历程了。
参考文献:
1. Thanigaimalai Pillaiyar, et al. "An Overview of Severe Acute Respiratory Syndrome−Coronavirus (SARS-CoV) 3CL Protease Inhibitors: Peptidomimetics and Small Molecule Chemotherapy". J. Med. Chem. 2016, 59, 6595–6628
2. Vincenzo Summa, et al. "Targeting SARS-CoV‑2 Proteases and Polymerase for COVID-19 Treatment: State of the Art and Future Opportunities". J. Med. Chem. November 13, 2020
3. Christoph Nitsche, et al. "The SARS-CoV-2 main protease as drug target". Bioorganic & Medicinal Chemistry Letters 30 (2020) 127377
4. Robert L. Hoffman, et al. "Discovery of Ketone-Based Covalent Inhibitors of Coronavirus 3CL Proteases for the Potential Therapeutic Treatment of COVID-19". J. Med. Chem. 2020, 63, 21, 12725–12747
5. Shengyong Yang, et al. "Crystal structure of SARS-CoV-2 main protease in complex with protease inhibitor PF-07321332".Science 371, 1374–1378 (2021)
6. DAFYDD R. OWEN, et al. "An oral SARS-CoV-2 Mpro inhibitor clinical candidate for the treatment of COVID-19". Science 2 Nov 2021

来源:Internet


