您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-03-09 13:35
胶囊剂是填充有非水液体、半固体或固体粉 末和颗粒的硬或软胶囊。溶出度是胶囊剂关键质 量属性,由于胶囊剂内容物与囊壳相互作用、外 部环境对内容物的影响、明胶囊壳交联等因素, 长期稳定性放置期间可能出现溶出度检测不合格 的情况。溶出方法选择不合理如囊壳漂浮或成团、 油状内容物漂浮等,也可能导致溶出度结果差异 较大。本研究参考 USP 通则<1094>梳理胶囊剂溶 出度试验的关注点,包括溶出介质、溶出装置以 及酶法破除明胶交联等。基于风险考虑从胶囊壳、 胶囊填充物、包装材料等方面提出胶囊剂溶出度 研究的一些思考。
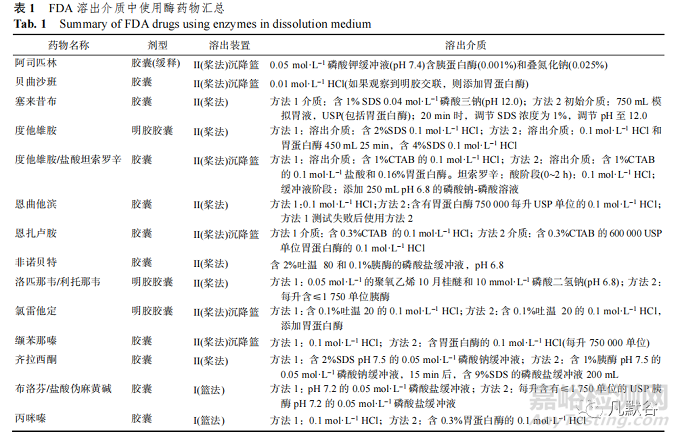
经检索 FDA 溶出度数据库 (Dissolution Methods Database Search),自 2004 年开始收载以 来,共计收载胶囊剂溶出方法 193 个,篮法 62 个, 桨法 131 个,其中 28 个选择沉降篮。13 个药物的 溶出介质中使用酶。使用酶的溶出方法占比 6.7%。
1、胶囊剂溶出度试验
1.1 增溶类物质的选择
溶出介质应满足漏槽条件。当胶囊填充物和/ 或原料药(active pharmaceutical ingredient,API)都 属于疏水性或者水不溶物质,可能需要选择含增 溶类物质的介质进行溶出。溶出介质不应与胶囊 壳或制剂产生相互作用,若使用酶破除明胶交联,介质也不应影响酶的活性。因此开发疏水性或者 水不溶填充物胶囊适用的介质可能需要大量的实 验考察。常见的增溶类物质包括:①阴离子类:十二烷基硫酸钠(sodium dodecyl sulfate,SDS)等;②阳离子类:十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB)等;③非离 子类:聚山梨醇酯(吐温)等[1]。
明胶胶囊剂溶出介质应慎重选择增溶类物 质,因为它们可能与囊壳发生相互作用而阻碍崩 解或溶解,也有可能抑制酶活性。SDS 是一种对 酶有抑制作用的表面活性剂,也是蛋白变性剂, SDS 可能使明胶蛋白变性,进而影响药物溶出[2]。研究表明在一定浓度的 SDS(0.05%~0.8%)存在下, 胃蛋白酶的活性均显著降低[3]。此外 SDS 还能与 钾离子形成不溶性沉淀。溶出介质中建议使用高 纯度的 SDS,低纯度 SDS 中的杂质可能干扰溶出 度测定。此外,在含有脂肪酸的制剂中,应避免使 用阳离子表面活性剂,因为可能形成不溶性沉淀[4]。
1.2 酶的选择
明胶交联可能导致溶出过程中囊壳内部或外 部表面形成不溶于水的薄膜,阻止胶囊填充物的 释放[5]。痕量醛(如甲醛、戊二醛、乙二醛等)引起 的交联是最常见的,此类交联需使用酶断裂交联 的肽键。此外还有三价金属离子(如 Fe3+和 Al3+)和 明胶中离子(如羧酸根、铵根)介导的较弱的离子交 联,一般可以通过更改介质的离子强度或 pH 值来 破除[6]。只有研究表明确实为明胶交联导致胶囊溶 出度不符合标准,才可在介质中添加酶。FDA 收 载的溶出介质使用酶的一些具体药物见表 1。
USP<1094>指南给出了酶选择的基本原则。酶的种类和用量取决于溶出介质的 pH 值,建议 pH≤4.0 介质使用胃蛋白酶,每升用量≤750 000 单位;pH 4.0~6.8 介质使用木瓜蛋白酶或菠萝蛋白 酶,木瓜蛋白酶每升用量≤550 000 单位或者菠萝 蛋白酶每升≤30 明胶消化单位(GDU);pH≥6.8 介 质使用胰酶,每升用量≤2 000 单位。
如果溶出介质包含使酶变性的表面活性剂或 其他成分,溶出试验中应先用酶进行预处理。预 处理介质不含表面活性剂或其他影响酶活性的成 分。FDA 溶出度数据库中收载的塞来昔布胶囊采 用两级溶出度测试程序,方法 1 不使用酶,溶出 介质为含 1% SDS 的 0.04 mmol·L−1 磷酸钠作为溶 充物比重比介质小,胶囊可能在介质中漂浮;胶 出介质;当溶出介质 1 不满足溶出度限度时,选择方法 2,即先使用含胃蛋白酶的模拟胃液 750 mL 预处理 20 min,之后添加 NaOH(调节 pH 至 12.0) 和 SDS 溶液(最终浓度为 1%)至 1 000 mL 完成后 续的溶出度测试。
1.3 溶出装置选择
胶囊剂溶出过程中可能会出现以下情况:填囊壳软化形成黏的或蜡状团块,黏附在溶出装置 上,导致测定结果呈现高变异性;有些胶囊填充 物可在溶出介质表面形成薄膜,如油状液体,也 可能导致胶囊溶出不完全,或产生高变异的溶出结果。
美国药典中收载了 4 种溶出装置,包括篮法、 桨法、往复圆筒法和流通池法。最常见的溶出度 装置是桨法和篮法。篮法具有固定胶囊的优点, 防止胶囊在介质中自由浮动,缺点是胶囊崩解后 填充物可能堵塞转篮网孔。解决办法是采用更大 孔径筛网。胶囊剂一般使用筛网孔径 40 目的转篮, 必要时使用 10~20 目筛网的转篮。FDA 数据库收 载的米诺环素胶囊选择 10 目筛孔的转篮,异维 A 酸胶囊选择 20 目孔的转篮。桨法不能防止胶囊漂 浮,可以使用沉降篮固定胶囊在容器底部。但需 要考察沉降篮的尺寸,因为胶囊与溶出介质接触 后会膨胀变大。流通池法适用于油脂类胶囊剂溶 出测定。
2、胶囊剂开发及溶出度研究
溶出度是胶囊剂的关键质量属性,胶囊剂的 良好质量应当是生产出来的,而非通过溶出度检 测出来的。胶囊剂溶出度控制应坚持处方开发研 究在前,检测检验在后的思路。采用风险评估的 理念,对囊壳质量、胶囊内含物(API 和辅料)、包 装等条件进行评估与控制,确保胶囊剂溶出度结 果持续符合质量标准。
2.1 囊壳
胶囊壳常规检查项目包括崩解时间、金属杂 质、水分、微生物限度等。囊壳大部分均为聚合 物材质,为保证质量一致应关注胶囊基材的聚合 度或者分子量,特别是软胶囊。以明胶为例,明 胶按照冻力强度可分为低强度(50~125 bloom g,分 子量 20 000~25 000)、中强度(175~225 bloom g, 分子量 40 000~50 000)和高强度(225~325 bloom g, 分子量 50 000~100 000)[7]。由于明胶原料来源和生 产工艺的不同,不同生产厂家的明胶强度可能存 在差异,甚至同一厂家不同批次也会不同。生产 中应对囊壳质量以及供应商进行适当的风险评 估,采取适当的控制手段。
为减少或消除胶囊剂本身引发的明胶交联, 可从以下方面考虑:①基材替换。使用改性纤维 素如羟丙基甲基纤维素 (hydroxypropyl methyl cellulose,HPMC)或其他多聚物代替明胶。这类基 材具备类似于明胶的胶凝特性,不会产生交联, 而且具备宽 pH 值和高温耐受性。②明胶化学改 性。可以通过化学改性减少醛诱导的交联反应, 例如在明胶分子链赖氨酸侧链引入琥珀酸基团[6]。③胶囊内容物处方优化。处方内容物使用低醛辅 料,或在壳处方中使用游离氨基(例如甘氨酸、赖 氨酸)与明胶竞争减少分子间交联[8]。
2.2 胶囊内容物
内容物与囊壳相容性良好是胶囊剂处方开发 的基本要求。还原糖类辅料的醛基会导致明胶交 联,从而导致溶出度检测结果变异较大,其他可 能降解产生痕量醛类杂质的辅料包括聚乙二醇、 聚山梨酯、羟丙基纤维素、微晶纤维素、羟丙甲 纤维素和淀粉等[9]。建议对胶囊内容物的各成分依 次进行风险评估并进行适当的控制,如吸湿性、 含水量、醛类和三价金属离子杂质水平等。尽可 能少用或不用还原糖。此外,由于外部因素的影 响,内容物中 API 在储存期间可能发生晶型转变 导致其稳定性末期溶出度不合格。如红外光谱和 X 射线粉末衍射(XRPD)技术检测稳定性末期的苯妥 英钠胶囊内容物,结果表明苯妥英钠和辅料乳糖 特征峰消失,苯妥英钠的相变以及与辅料的相互 作用是导致溶出超限的主要原因,与囊壳质量无 关[10]。HPMC 胶囊不需要考虑明胶交联的问题, 但由于其透水性与明胶囊壳类似,同样需要考虑 外部环境因素对内容物理化性质的影响[11]。
2.3 包装
明胶暴露于剧烈的外部环境条件下会发生交 联,物理条件如高温、高湿、紫外线辐射、γ 辐射 和快速干燥;化学条件如醛、酮、亚胺和碳二亚胺 以及酶类,如转谷氨酰胺酶[12]。对于 API 含有酯键 或酰胺键的,水分影响其稳定性,应严格控制水分 含量。胶囊最常见的包装是塑料瓶和泡罩,铝箔的 水分隔离能力强于塑料包装。包装研究对于胶囊剂 至关重要,应在产品开发早期进行研究,包括药品 储存的研究以及多剂量药品包装开启后的研究。包 装材料的厚度和材质与包材性能密切相关,评估包装系统性能的最重要的指标是水蒸气透过率,其他 指标包括透光率和透氧率[13]。包装开启后吲哚美辛 胶囊溶出度不合格,这是由于吲哚美辛吸水导致 晶型变化。采用带有封口的铝袋包装可以有效防 止溶出度显著下降,这种包装适合多剂量药品启 封后的储存[14]。新型干燥剂的使用是胶囊包装保 护的另一种策略。相比传统的硅胶干燥剂,活性 炭在湿度<50%时吸水较少,但在湿度>50%时水分 吸附能力显著增加,同时也能够吸附甲醛等气体, 这些优势对于胶囊特别是明胶胶囊可能会有较好 的应用前景[15]。
2.4 溶出试验
应根据胶囊轻重、胶囊填充物理化性质等, 选择合适的溶出装置及溶出介质。对于使用酶破 除明胶交联的情况,溶出方法可能需要两级溶出 度测试程序。此外也应评估 pH、离子强度、缓冲 离子对和增溶类物质对 API 溶解度和酶活性的影 响。采用两级溶出方法,添加木瓜蛋白酶对消除 氟伐他汀胶囊胶囊壳的交联具有明显作用,平均 溶出度可提高 5%~7%[16]。溶出度检测方法也需要 经过验证,如取样方法、放置时间、滤膜过滤吸 附等。早期开发阶段通过在辅料中掺入一定量的 甲醛或其他交联剂、或者将胶囊暴露于甲醛蒸汽 中、或者将胶囊暴露于高温高湿条件下,可以人 为制造明胶交联囊壳[17]。人为形成的交联可以对 使用酶的必要性进行论证,同时也有助于溶出方 法的建立,如溶出介质中使用酶的类型、数量、 孵育时间等。
2.5 崩解时限替代溶出度
ICH Q6A 规定,对于溶解度较好且在多种介 质中能够快速溶出的制剂,如果能够建立崩解时 限与溶出度的相关性,则可以采用崩解时限替代 溶出度检查。这主要是基于快速溶解的药物崩解 后即视为溶解。除了快速溶出的制剂外,也有肠 溶胶囊崩解时限和溶出度相关性的研究报道[18]。部分软胶囊可采用崩解时限或破裂试验作为溶出 度检查的替代方法[19]。中国药典 2015 年版二部收 载硬胶囊大部分需要进行溶出度试验,收载的 17 种软胶囊中,仅尼莫地平软胶囊需进行溶出度试 验,其余均进行崩解试验。
3、展望
溶出度是口服固体制剂的关键质量属性,也 是研发及申报过程中主要关注的质量指标。由于胶囊内容物差异的特点,胶囊剂溶出度方法具有 其特殊性,因此除考虑常规的溶出度方法的区分 力研究外,还应当关注溶出度方法的适宜性,通 过装置以及方法的选择和设计保证溶出度检测方 法的可靠性。新版中国药典 2020 年版溶出度方法 收载了 7 种装置方法,较中国药典 2015 年版增加 往复筒法和流池法,也为今后胶囊剂溶出度研究 提供了更多选择。胶囊壳材质种类较多,囊壳材 质质量的控制与溶出度相关,因此应该对囊壳供 应商进行适当的审计,并建立适当的囊壳内控标 准。明胶囊壳可能在储存期间发生交联导致溶出 结果变化,特别是内容物中存在小分子醛类杂质 或者胶囊处于较为剧烈的外部环境。针对明胶胶 囊,在处方开发中应对原辅料种类及其潜在杂质 进行评估,并选择适宜的包装材料避免外部环境 影响,为产品有效期末溶出度结果符合要求提供 保障。

来源:中国现代应用药学


