您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-01-17 23:04
摘 要:目的 制备他达拉非片并考察其体内外释药特性。方法 以溶出度为评指标,筛选他达拉非片各辅料用量及包衣增重。用相似因子(f2)法比较自制制剂与参比制剂在0.5%SDS溶液、含0.5%SDS的0.1mol/L的盐酸溶液、含0.5%SDS的pH 4.5醋酸钠缓冲液、含0.5% SDS的pH 6.8磷酸盐缓冲液中溶出曲线的相似性。比较二者在Beagle犬体内的药动学特征。结果 他达拉非片处方为他达拉非20mg、乳糖50M227.625mg、羟丙基纤维素 L10.5mg、交联羧甲基纤维素钠19.6mg、SDS0.525mg、微晶纤维素M10270 mg、硬脂酸镁1.75mg,包衣增质量范围2%~4%。自制与参比制剂在4种溶出介质中的f2 均大于65,二者体外溶出行为相似。2种制剂在Beagle体内的药学参数AUC0 ~ t 、Cmax 、tmax 均无显著性差异,自制他达拉非片的相对生物利用度为(101.67±8.99)%。结论 成功制备他达拉非片,其体外溶和体内药动学行为与参比制剂相似。
他达拉非是环磷酸鸟苷(cGMP)特异性磷酸二酯酶 5 的可逆性抑制剂,通过增加阴茎海绵体内cGMP水平使平滑肌松弛,导致阴茎血流量增加而起到治疗男性勃起功能障碍(erectile dysfunction,ED)的作用,与其他治疗ED药物相比,他达拉非具有选择性高,半衰期长,耐受性好等优点[1-3]。此外,他达拉非还可用于肺动脉高压、良性前列腺增生等疾病的治疗[4-5]。他达拉非由礼来公司研发,2003年11 月23日经美国 FDA 批准上市,商品名为希爱力 ® ,上市剂型为速释片剂,规格为 20.0、10.0、5.0、2.5mg。
近年来,仿制药质量和疗效一致性评价工作不断推进,本研究以国家药品监督管理局公布的参比制剂目录为依据,选定由礼来公司生产的希爱力 ® 作为参比制剂仿制了规格为20 mg的他达拉非片,并以溶出度为评价指标,对他达拉非片的各辅料用量和包衣增质量进行优化筛选[6-8] ,同时考察了自制制剂和参比制剂体外溶出行为及二者在人体内的药动学特征,比较二者的体内外释药特性。
一、材料
1.1 仪器
VG65/10 型混合制粒机、Combo 250 型流化床(德国Glatt公司);Comil-U5型SLS可拓展多功能实验系统(英国 Fitzpatrick 公司);HBD-50 型混合机(南通贝特医药机械有限公司);P3030 型压片机(菲特压片机械有限公司);Perfima型包衣机(意大利 IMA 公司);Distek 2500 型智能溶出仪(美国Distek 公司);UltiMate 3000 型高效液相色谱仪、Finnigan TSQ Quantum Ultra型三重四极杆质谱仪,配有电喷雾离子源(ESI)和 Xcalibur3.0 工作站(美国Thermo公司)。
1.2 药物及主要试剂
他达拉非原料药(山东特珐曼药业有限公司,批 号 20191002);他 达 拉 非 对 照 品(自 制 ,批 号191201,质量分数99.48%);他达拉非参比制剂(美国礼来制药有限公司,批号C931765A,规格20mg);乳糖200M(荷兰DMV公司);羟丙基纤维素L(日本曹达株式会社);十二烷基硫酸钠(SDS,德国巴斯夫股份公司);微晶纤维素M102(明台化工股份有限公司);交联羧甲基纤维素钠(德国 J.RettenmaierSohne GmbH Co.KG);硬脂酸镁(荷兰Peter GrevenNederland C.V.);薄膜包衣预混剂(型号32K52002-CN,上海卡乐康包衣技术有限公司);水为纯化水、乙腈为色谱纯,其他试剂均为分析纯;地西泮标准品(中国食品药品检定研究院,批201211-231707,质量分数99.97%)。
1.3 动物
6只雄性Beagle犬,体质量8~12 kg,购于北京玛斯生物技术有限公司,实验动物生产许可证号SCXK(京)2016-0001。实验犬身体均健康,实验前1周未服用任何药物。
二、方法与结果
2.1 他达拉非片的制备
称取他达拉非原料药 20g、乳糖 50M 227.6g、羟丙基纤维素L 10.5g、交联羧甲基纤维素钠9.8g,一起置于湿法制粒机中混合10min,另将 0.533gSDS溶于50.4g纯化水中,加至上述混合物中湿法制粒,干燥后过 1 mm 筛网整粒,将微晶纤维素M10270g和交联羧甲基纤维素钠9.8 g加入内颗粒中混合10 min,再加入硬脂酸镁1.75g混合5min,压片,包衣,即得。
2.2 溶出度测定方法的建立
2.2.1 色 谱 条 件 色 谱 柱 辛 基 硅 烷 键 合 硅胶(Agilent Zorbax SB-C8 ,5.0cm×4.6mm、3.5μm);检测波长225nm;流动相甲醇和水(50∶50);柱温40℃;体积流量1.0mL/min;进样体积50µL。
2.2.2 溶液制备
对照品溶液:精密称定他达拉非对照品25mg,至100 mL容量瓶中,用乙腈-水(1∶1)溶液超声溶解并稀释成0.25g/L 的贮备液,再取贮备液4mL,至50 mL量瓶中,用溶出介质稀释成20 mg/L的对照品溶液。
供试品溶液:取自制和参比制剂各6片,按照溶出度测定浆法,以1000mL 0.5% SDS溶液为溶出介质,转速为50r/min,分别于 5、10、15、20、30、45 min 取溶出液5.0mL(不补液),用0.45μm滤膜过滤,弃去3mL,取续滤液2mL作为供试品溶液。按照“2.2.1”项色谱条件测定,按外标法以峰面积计算累积溶出度,绘制溶出曲线。
2.2.3 方法学验证
(1)专属性考察:取溶出介质溶液、相应的空白辅料溶液、供试品溶液和对照品溶液,照“2.2.1”项下色谱条件进样分析,结果显示各溶出介质和辅料对主成分的测定均无干扰,对照品溶液和供试品溶液中主峰保留时间一致,表明该方法专属性良好,代表性图谱见图1。
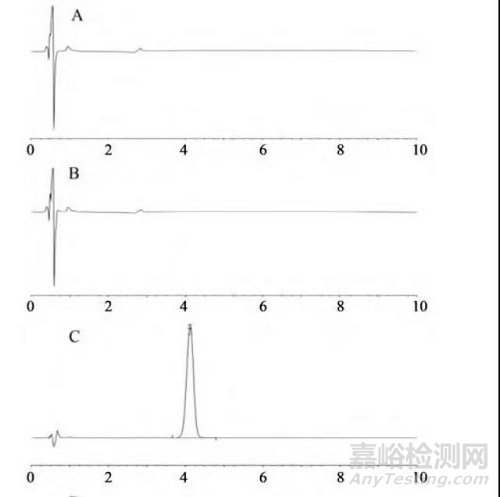
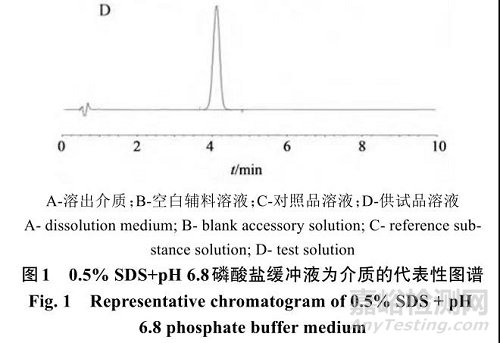
(2)线性关系考察:取对照品溶液适量,加溶出介质逐级稀释为质量浓度分别为 0.5、2.5、5、10、20、30、40μg/mL的溶液,按照“2.2.1”项色谱条件测定,结果表明,他达拉非质量浓度在0.509 3~30.557 4 μg/mL与峰面积线性关系良好,回归方程 Y=7×10−6X-1.698×10−3 ,r=0.999 98。
(3)滤膜吸附性考察:将溶出液分成2份,一份离心取上清液,另一份过滤2、4 mL后取续滤液,按照“2.2.1”项色谱条件测定,过滤2、4 mL所得续滤液的峰面积分别为离心所得上清液测得的峰面积的99.75%、100.01%,说明滤膜对他达拉非无吸附。
(4)重复性考察:溶出 45 min时于同一溶出杯中平行取6份供试品溶液,由不同人在不同仪器测定供试品的溶出度,结果显示 6 份供试品溶液的RSD为0.59%。
(5)回收率考察:分 别 精 密 称 取 约 1.6、2.0、2.4 mg的他达拉非原料药置100 mL量瓶中,再加入处方中的其他辅料,用溶出介质稀释至刻度,摇匀,作为80%、100%、120%浓度水平的供试品溶液,平行制备3份,进样测定,3个浓度范围内的平均回收率 分 别 为 99.68%、99.91%、99.77%,RSD 值 为0.12%,回收率符合规定。
(6)溶液稳定性考察:溶出供试溶液和对照品溶液室温放置,分别于0、4、8、12、24、48 h取样,进样分析,RSD 分别为 0.11%、0.60%,说明室温放置48 h内稳定性良好。
2.2.4 溶出曲线相似性评价 溶出曲线的相似性一般采用f2 相似因子法进行评价,计算公式如下。
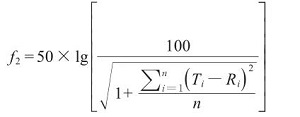
n为取样时间点个数,T i 和R i 分别为各取样时间点自制制剂和参比制剂平均溶出度。
根据溶出曲线的相似性计算方法,他达拉非片自制品和参比制剂通常取3个点以上的溶出度结果进行计算,f2 >50时,表明两条溶出曲线相似,f2 越大溶出曲线相似性越大。
2.3 单因素考察
他达拉非在药剂学分类系统中为BCS II类,即低溶解性、高渗透性药物[9] ,影响此类药物片剂质量的因素主要为稀释剂、黏合剂、崩解剂等。本研究以溶出度为评价指标,采用单因素试验对上述因素分别进行筛选。
2.3.1 乳糖50M与微晶纤维素比例的考察
乳糖50M和微晶纤维素M102均为稀释剂,二者比例可以影响药物溶出[8] 。按照“2.1”项下方法,分别以乳糖50M和微晶纤维素M102质量比为5∶3、3∶1、7∶1制备片剂,考察其在0.5% SDS溶液中的溶出度,结果见图2。
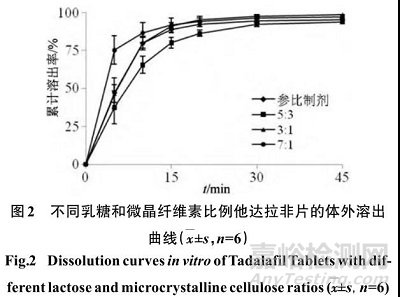
如图2所示,随着乳糖50M和微晶纤维素M102质量比增加,他达拉非片溶出速度随之增加。计算3 种自制与参比制剂溶出曲线的 f 2 值分别为 57.1、93.5、49.2,且在压片过程中发现乳糖50M和微晶纤维素M102质量比为5∶3时,细粉较多,物料流动性差,容易黏冲,综合上述因素,确定乳糖50M和微晶纤维素M102质量比为3∶1。
2.3.2 黏合剂种类及用量的考察
为保证自制片剂与参比制剂的一致性,选择羟丙基纤维素和羟丙甲纤维素为黏合剂。按照“2.1”项下方法,分别以羟丙基纤维素L用量3%、4%,羟丙甲纤维素E5LV用量3%、4%制备片剂,照“2.2”项下方法进行溶出度考察,结果见图3。
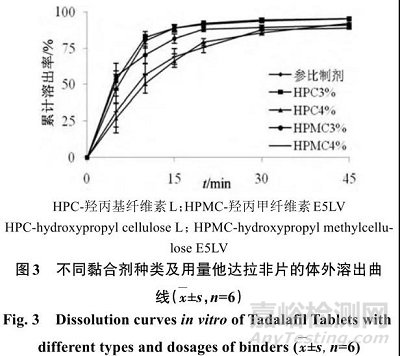
在制粒过程中发现,羟丙基纤维素L和羟丙甲纤维素E5LV用量为4%时,所制得颗粒较硬,导致片剂崩解较慢;羟丙基纤维素 L 和羟丙甲纤维素E5LV用量为3%时,颗粒较均匀、流动性与可压性均较好,所制得片剂性质在可接受标准之内。计算羟丙基纤维素L用量3%、4%和羟丙甲纤维素E5LV用量3%、4%时所制片剂与参比制剂溶出曲线的f 2值分别为80.3、40.0、62.9、43.2,综合考虑,选择羟丙基纤维素L为黏合剂,处方量为3%。
2.3.3 交 联 羧 甲 基 纤 维 素 钠 用 量 的 考 察
按照“2.1”项下方法制备片剂,考察交联羧甲基纤维素钠用量为 1.5%、2.8%、4.0% 时 ,对他达拉非片在0.5% SDS溶液中溶出的影响,结果见图4。
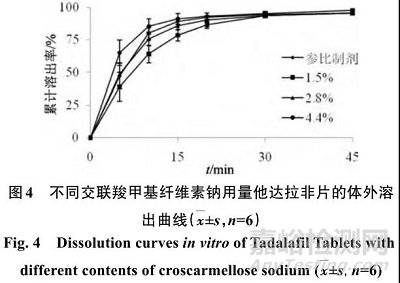
由图4中3种片剂溶出曲线可知,随交联羧甲基纤维素钠用量的增加溶出速度加快,计算3者与参比制剂溶出曲线的f 2 值分别为55.8、82.9、58.4,观察到交联羧甲基纤维素钠用量为2.8%时所制片剂与参比制剂的溶出最为相似。经考察,交联羧甲基纤维素钠的加入方式采用内外加时,能保证片剂溶出速率的均衡,故确定交联羧甲基纤维素钠用量为2.8%,其中 1.4% 加入内颗粒中,另 1.4% 加入外颗粒中。
2.3.4 SDS 用量的考察
他达拉非原料药几乎不溶于水,因此需要加入增溶剂以保证其溶解,选用SDS为增溶剂,按照“2.1”项下方法,分别以SDS用量 0.10%、0.15%、0.20% 制备片剂,考察其在 0.5%SDS溶液中的溶出行为,结果见图5。
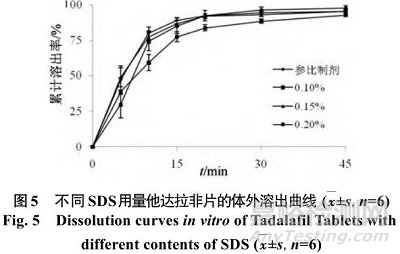
如图5所示,SDS用量与45 min时片剂累计溶出率呈正相关,但 SDS用量为 0.20% 时 5 min溶出度较低,原因为SDS用量过大会降低溶出介质的表面张力,不利于片剂崩解。计算自制片剂与参比制剂溶出曲线的 f 2 值分别为 50.7、88.2、59.4。选择SDS用量为0.15%。
2.3.5 硬脂酸镁用量的考察
按照“2.1”项下方法,分别以硬脂酸镁用量 0.25%、0.50%、0.75% 制备片剂 ,按照“2.2”项下方法进行溶出度考察 ,结果见图6。
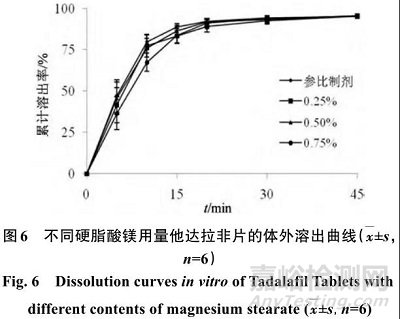
如图6所示,硬脂酸镁用量对他达拉非片的溶出无影响。硬脂酸镁用量为 0.25%、0.50%、0.75%时,f 2 值依次为74.3、86.3、60.6。但在压片过程中发现硬脂酸镁用量为0.25%时,存在黏冲现象,不利于操作。从处方耐用性考虑,最终选择硬脂酸镁用量为0.5%。
2.3.6 包衣增质量的考察
包衣增质量对药物的溶出也有影响,按照“2.1”项下方法制备片剂,包衣增质量分别为2%、3%、4%,考察包衣增质量对药物在0.5% SDS溶液中溶出的影响,结果见图7。
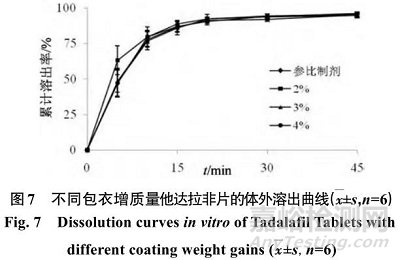
如图7所示,包衣增质量为2%、3%、4%时对他达拉非片的溶出行为无明显影响,计算f 2 值依次为61.4、90.9、87.5,因 此 将 包 衣 增 质 量 设 定 在2%~4%。
2.4 处方工艺的验证
2.4.1 含量与有关物质检测方法
根据美国药典各论中收载的他达拉非片检测方法进行含量和有关物质的检测,具体操作如下:
(1)色 谱 条 件 :色 谱 柱 辛 基 硅 烷 键 合 硅胶(Agilent Zorbax SB-C8 ,15.0cm×4.6mm,3.5μm);检测波长285nm;乙腈、水和三氟乙酸(35∶65∶0.1)为流动相;柱温35 ℃;体积流量1.0 mL/min;进样体积10 µL。
(2)样品溶液制备:取25片片剂,置500mL量瓶中,加约400mL稀释液[乙腈和水(1∶1)],机械振摇15min,使片剂分散,用稀释液定容,摇匀,静置至少1h后,精密量取上述溶液2.5mL,置10 mL量瓶中,用稀释液稀释至刻度,摇匀,过0.45µm滤膜,弃去3mL,取续滤液检测。
2.4.2 含量均匀度
称取1片片剂,置200mL量瓶中,加入体积约100mL稀释液[乙腈和水(1∶1)],机械振摇15min,用稀释液定容至刻度 ,摇匀 ,过0.45 µm 滤膜,弃去3mL,取续滤液,采用紫外分光光 度 法 ,在 285 nm 波 长 处 测 定 样 品 溶 液 吸 光度(A)值。
2.4.3 优化处方的确定
中试批(批量60000片):将他达拉非原料药1.200kg、乳糖50M13.657kg、羟丙基纤维素L0.630kg、交联羧甲基纤维素钠0.588 kg一起过20目筛后,置于湿法制粒机中混合10min;另将 0.032kg SDS溶于3.024 kg纯化水中,加至上述混合物中制软材,过5mm筛网制粒,于40 ℃流化床干燥至颗粒水分≤2%,过1mm筛网整粒;将微晶纤维素M102 4.200 kg 和交联羧甲基纤维素钠0.588kg加入内颗粒中混合10min (转速10r/min),加入过60目筛的硬脂酸镁0.105g,总混5min (转速10r/min),压片,冲模尺寸12.7 mm×7.5mm,控制片质量339.5~360.5mg,片剂硬度80~100N,包衣,得3批中试片剂(批号 200701、200702、200703)。取中试3批的他达拉非片,依法检测质量分数、含量均匀度、溶出度、有关物质,结果见表1。
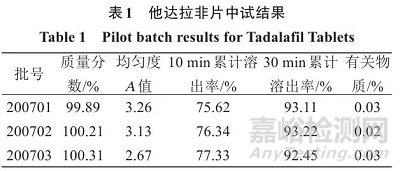
如表1所示,中试3批他达拉非片的质量分数、含量均匀度、有关物质结果均符合《中国药典》2020年版的要求 ;按照“2.2”项下方法测定溶出度 ,在 10 和 30 min 累计溶出率的RSD分别为4.64%、1.00%,表明自制片剂的溶出均一性好;按照“2.2”项下方法测定溶出曲线,累计溶出率的RSD值均小于10%,结果表明自制片剂工艺稳定、中试批的批间重现性良好。
2.4.4 体外溶出行为的比较
取自制他达拉非片,分别测定其在 0.5% SDS 溶液(A)、含 0.5% SDS的 0.1 mol/L 的盐酸溶液(B)、含0.5% SDS的pH 4.5醋酸钠缓冲液(C)、含0.5% SDS的pH 6.8磷酸盐缓冲液(D)4种溶出介质中的溶出度,绘制溶出曲线,见图8。并与他达拉非参比制剂的溶出曲线进行比较,溶出曲线的f 2 值见表2。
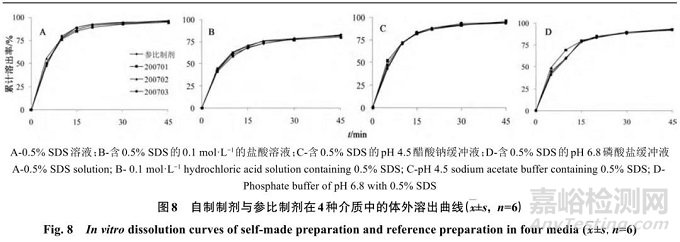
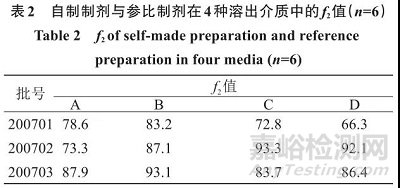
按溶出行为相似因子f 2 法进行判断,只要f 2 值大于50即可认定为溶出行为相似[10] ,由表2可知,自制制剂与参比制剂4种溶出介质中溶出曲线的f 2 值均大于65,由此判断,2者在4种溶出介质中的体外溶出行为相似。
2.5 体内药动学研究
2.5.1 给药方法与血样采集
采用单剂量双周期交叉试验方案,将6只雄性Beagle犬随机分为A、B两组,每组3只,试验前禁食至少12h,采完空白血液后,可饱腹给药。A 组 Beagle 犬 ig 参比制剂 1片(规格20 mg),B组Beagle犬ig自制制剂1片(规格 20mg),采集样品结束后 ,经1周洗脱期 ,给Beagle犬交叉服药。
分别在给药后0.33、0.67、1.00、1.50、2.00、2.50、4.00、8.00、12.00、24.00、36.00、48.00、64.00 h 于Beagle犬的前肢或后肢静脉取血4 mL,置1%肝素抗凝的离心管中,在3000r/min离心10min后,取上清液置于−20 ℃冰箱中保存待测。
2.5.2 血浆样品测定[11]
色谱条件:色谱柱 Shim-pack Scepter C 18 -120(100mm×2.1mm,3mm);流动相10 mmol/L乙酸铵溶液–甲醇(10∶90);体积流量0.3mL/min;柱温40 ℃。
质谱条件:电喷雾电离源;正离子模式;多重反应监测;毛细管温度350 ℃;鞘气5.25 MPa;辅助气1.75 MPa;他达拉非和内标地西泮的碰撞电压为40、35 V、碰撞能为22、30 eV;用于定量分析的离子反 应 分 别 为 m/z389.5→258.2(他 达 拉 非)、m/z284.3→151.4 (地西泮)。
血浆样品的处理:取各时间点血浆样品300μL,加入质量浓度为200 ng/mL的地西泮内标溶液(甲醇溶解、稀释)30μL,涡旋混匀后,加入醋酸乙酯4mL,再涡旋3min。3000r/min离心10min,取上清液3.0mL,用氮气在室温下吹干,用100μL流动相复溶,涡旋3min,6000r/min离心10min,取上清液进样测定。
2.5.3 检测结果
Beagle犬ig给予参比制剂和自制制剂后,平均血药浓度-时间曲线见图9。
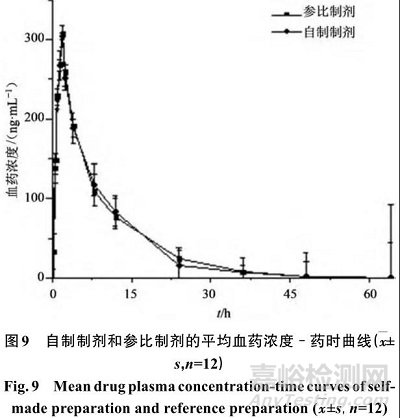
不同时间点血药浓度经DAS 2.0药动学软件的非房室模型拟合,主要药动学参数见表3。
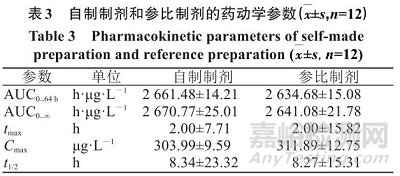
对自制制剂和参比制剂药动学参数进行配对t检验分析,结果无统计学差异,表明2个制剂在人体内释药特征无明显差异。与参比制剂相比,自制片剂的口服相对生物利用度为(101.67±8.99)%。
三、讨论
生物药剂学分类系统中,在37 ℃、pH值1.0~7.5内,单次最大给药剂量的药物可溶于不多于250mL的介质时,则认为该药物是高溶解性的,反之为低溶解性[9]。他达拉非单次最大给药剂量为20mg,经溶解度预试验,20mg 他达拉非原料药在纯化水、0.1mol/L的盐酸溶液、pH 4.5醋酸钠缓冲液、pH 6.8磷酸盐缓冲液中完全溶解所需体积依次为 5882、6250、6666、7407mL,均大于250mL,由此可判断他达拉非为难溶性药物。
以参比制剂的溶出行为,考察溶出度曲线的区分力。他达拉非参比制剂在 0.5%SDS 溶液、含0.5%SDS 的0.1mol/L 的盐酸溶液、含 0.5%SDS 的pH 4.5醋酸钠缓冲液、含0.5%SDS的pH 6.8磷酸盐缓冲液中,10min 溶出度达 40%,30min 溶出度达80%,因此,用其作为溶出介质考察自制制剂与参比制剂的体外释药特性。
体内实验采用单剂量双周期交叉试验方案,分别考察了自制制剂与参比制剂在Beagle犬体内的药动学参数。采用 LC-MS/MS法测定他达拉非的血浆浓度,该法重现性好、专属性强,可满足他达拉非血浆浓度的测定要求。对自制制剂和参比制剂体内药动学参数进行统计学分析,结果无显著性差异,说明二者在体内的药动学过程相似。
本研究成功仿制了他达拉非片,其处方工艺可实现中试批次生产,重现性良好,产品质量均符合质量标准。体内外评价表明,自制制剂与参比制剂的体外溶出行为相似,体内药动学参数无显著性差异,符合仿制药质量和疗效一致性评价的要求,为他达拉非片的研发和生产提供了有力的科学依据。

来源:Internet


