您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-01-14 14:33
近日消息,北京湃生生物科技有限公司(以下简称“北京湃生”)“可吸收生物修复膜”成功获NMPA批准,获准上市,注册证编号:国械注准20213171114。
▲北京湃生“可吸收生物修复膜”实物图
值得一提的是,北京湃生自主研发生产的“胶原蛋白海绵”(注册证编号:国械注准20193170276)也于2019年4月成功获批上市,成为中国大陆地区口腔软组织修复领域首个获NMPA批准上市的、植入级产品。至此,北京湃生旗下共计有两款III类重磅产品获批上市。
“可吸收生物修复膜”的获批上市,进一步丰富北京湃生的口腔产品线,填补在口腔种植领域的空白,结合目前已上市“胶原蛋白海绵”系列产品(胶原塞、胶原块、胶原片、胶原基质瓣、胶原基质盖),以及口腔护理系列产品(口腔抑菌喷剂、口腔抑菌含漱液、口腔抑菌膏、口腔抑菌凝胶、创口贴、溃疡贴、牙菌斑指示剂等),可以在口腔领域的术前、术中、术后覆盖整个服务管理线,应用范围更广,更好更全面的满足市场需求,进一步增强北京湃生在口腔领域的产品和服务竞争力。
关于“可吸收生物修复膜”
据了解,市场上现有的同类产品为牛皮、猪皮、猪小肠粘膜下等脱细胞基质ECM材料,是天然材料通过脱细胞工艺制备而成,制备工艺较为简单,具有较高的免疫原性风险。
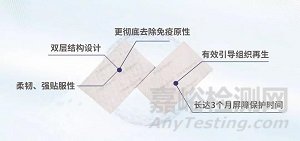
“可吸收生物修复膜”采用了去端肽胶原体外分子自组装和材料结构设计技术,是第三代胶原蛋白技术应用的代表性产品。相关技术既保留了天然材料具备的力学性能,使得该产品既有天然胶原材料的柔韧性,又具备更好的免疫原性去除效果。据介绍,第三代胶原技术制备的“可吸收生物修复膜”具备以下特征:
1、无免疫原性。该产品在中国食品药品检定研究院进行了完整的免疫原性研究评价,研究结果显示:免疫原性未检出,与脱细胞基质材料相比,可吸收生物修复膜更彻底的去除了免疫原性。
2、同时具备致密层和疏松层清晰的双层结构设计。致密层(光滑面):层状胶原纤维力学强度好、耐受胶原酶降解,阻隔牙龈上皮及结缔组织细胞迁移,起到隔离作用;疏松层(粗糙面):呈多孔结构,利于细胞贴壁爬行生长,与骨组织接触,为成骨细胞的粘附和骨的沉积提供附着的载体,使新生成的骨组织能与膜贴合。
3、优异的力学性能。柔韧、强贴服性、可缝合线缝合。
4、优异的生物相容性。在NMPA认可的检验机构,完成了全项生物相容性评价,结果证明:艾瑞金可吸收生物修复膜具有良好的生物相容性,符合GB/T 16886医疗器械生物学评价的要求。
5、具有优异的病毒灭活效果。依据NMPA相关标准要求,在中国食品药品检定研究院完成了病毒灭活/去除工艺效果验证,对4种典型代表性病毒降低量>9log,远超国家标准要求的6log。
6、专利技术保障。可吸收生物修复膜是由去端肽胶原体外分子自组装技术、和材料结构设计技术制备而成,该技术已获得多项国家专利保护。

来源:北京湃生


