您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-12-05 21:30
摘 要 Abstract
基于特许药械政策支持,截至2021 年10 月,海南博鳌乐城国际医疗旅游先行区特许药械真实世界数据研究已开展第2 批真实世界临床数据研究试点工作。期间基于博鳌乐城真实世界数据的特许创新医疗器械“青光眼引流管”获得了国家药监局批准,表明真实世界数据可以作为药品获批的有效科学依据,被认为具有重大的改革创新意义。本研究团队在前期方法学理论研究和特许药械真实世界临床评价实践的基础上,结合国内外真实世界数据研究最新的技术指导原则和技术规范,探讨博鳌乐城特许药械真实世界数据研究的模式、设计和数据库构建,以期为监管部门、申办方和相关学者在博鳌乐城开展特许药械真实世界数据研究提供参考。
As of October 2021, with the support of special drug policies, real-world studies conducted in Boao Lecheng International Medical Tourism Pilot Zone in Hainan has delivered two pilot programs on real-world clinical data. Based on real-world data obtained from Boao Lecheng’s medical institution, the marketing application of the XEN Glaucoma Treatment System has been approved by the National Medical Products Administration, indicating that real-world data can be used as an effective scientific basis for drug approval, which is considered an innovative regulatory reform. Based on our preliminary methodological research and the real-world clinical evaluation of special drugs and medical devices conducted in Boao Lecheng, as well as the latest technical guidelines and specifications on real-world study issued by regulatory authorities from China and aboard, this study analyzes and summarizes the research pattern, design and database construction for the real-world study of special drugs and medical devices in Boao Lecheng. It is expected to provide information for regulatory authorities, sponsors and relevant scholars to conduct real-world study of special drugs and medical devices in Boao Lecheng.
关键词 Key words
博鳌乐城;特许药械;真实世界数据;研究模式;数据库
Boao Lecheng; special drugs and medical devices; real-world data; research pattern; database
基金项目
四川省青年科技创新研究团队(2020JDTD0015);四川大学华西医院学科卓越发展 1·3·5 工程项目(ZYYC08003);美国中华医学基金会项目(CMB19-324)
近年来,国内外监管部门大力支持真实世界证据(real-world evidence,RWE) 在药物研发和监管决策的应用与发展。2019年4 月,为推动监管理念和机制创新,国家药监局启动中国药品监管科学行动计划[1],并确定了首批9 个重点研究项目,其中2项涉及RWE。2020 年,国家药监局发布了《真实世界证据支持药物研发与审评的指导原则(试行)》[2] 和《真实世界数据用于医疗器械临床评价技术指导原则(试行)》[3] 等系列真实世界数据(real-world data,RWD)相关指导原则,标志着我国药物临床研发与评价进入了一个新的发展阶段。
海南博鳌乐城国际医疗旅游先行区(以下简称“博鳌乐城”)是目前全国唯一的临床RWD 应用试点研究区域。在特许药械政策的支持下,博鳌乐城被赋予特许医疗、特许经营、特许研究及特许国际交流等优惠政策, 允许一些在国外已经上市、国内尚未注册的临床急需创新药械产品在博鳌乐城先行区使用。此外,博鳌乐城还拥有国际最新医疗产品在中国人群的独有RWD,这不仅为我国开展基于RWD 的特许药械审评审批实践研究提供了珍贵的数据资源,而且为提高全球创新药械产品在我国的可及性提供了新的途径和方案,其研究成果将助力我国药械监管科学创新。2020 年3 月,基于博鳌乐城RWD“青光眼引流管”获批上市,成为我国首个使用境内RWD 获批的医疗器械产品,表明真实世界数据可以作为药品获批的有效科学依据,被认为具有重大的改革创新意义。
本文基于前期理论方法学研究和博鳌乐城特许药械RWD 项目实践, 总结了特许药械政策下RWD 的研究模式体系、研究设计和数据库的构建,通过具体实证案例,对博鳌乐城特许药械RWD 研究的关键设计考虑进行了分析,以期为监管部门、申办方和相关学者在博鳌乐城开展特许药械RWD 研究提供参考。
1 特许药械政策下RWD研究的特点
2019 年6 月,国家药监局与海南省人民政府联合启动了海南临床RWD 应用试点工作[4]。2019年9 月,四部门联合印发《关于支持建设博鳌乐城国际医疗旅游先行区的实施方案》[5],允许博鳌乐城特许药械通过真实世界临床数据的应用研究,把在先行区试用药品和器械过程中积累的符合要求的临床数据作为在中国申请注册的依据。2021 年4 月,《国家发展改革委 商务部关于支持海南自由贸易港建设放宽市场准入若干特别措施的意见》[6] 发布,进一步创新海南医药卫生领域市场准入方式,对博鳌乐城特许药械RWD 研究项目的开展起到了巨大的推动作用。
与传统RWD 研究相比,博鳌乐城特许药械RWD 研究具有以下特点[7] :①唯一性:相较于国内其他地区,博鳌乐城允许一些国内未上市而国外已上市的创新药械在先行区使用,使得博鳌乐城具有特许创新药械的独有性和特许医疗干预实施地点的唯一性。②广泛性:全国各地患者由居住地医疗机构的临床专家推荐到博鳌乐城的医疗机构接受特许药械治疗,出院后回居住地医院进行复查和随访,患者来源具有广泛性, 也反映了特许药械RWD 的多样性。③多元性:通过RWD 研究,特许药械不仅具有中国人群的RWE,而且已积累国外随机对照临床试验证据和RWE,同时部分特许药械已在国内开展随机对照临床试验,显示出特许药械证据来源的多元性。
2 基于特许药械政策RWD 研究的一般模式
经过初步探索与实践,博鳌乐城特许药械RWD 研究的总体流程大致可以分为6 个步骤(图1):①根据研究目标或需求,制定研究问题:包括人群、干预/暴露、对照、结局、观察时间等要素[8]。②建立多学科交叉团队:应至少包括临床专家、RWD 研究专家、数据收集、获取团队[9]。③评估数据资源及质量:特许药械的RWD 质量应符合监管所需条件,应对特许药械RWD 进行准确性、适用性、完整性等评价[10]。④构建研究方案并获得伦理支持:构建的研究方案需满足监管审评要求,需要考虑研究设计、数据库类型、数据采集方式、统计学分析等[11-12]。⑤构建研究型数据库:根据研究目的和研究模式,构建适用于评价品种的研究型数据库,通常可以通过搭建患者登记数据库完成[13-15]。⑥统计分析:所有研究均需提前制定统计分析计划,应严格根据统计分析计划内容对数据进行统计分析[16]。
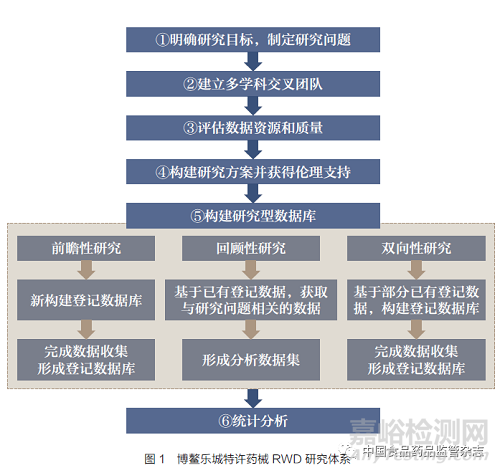
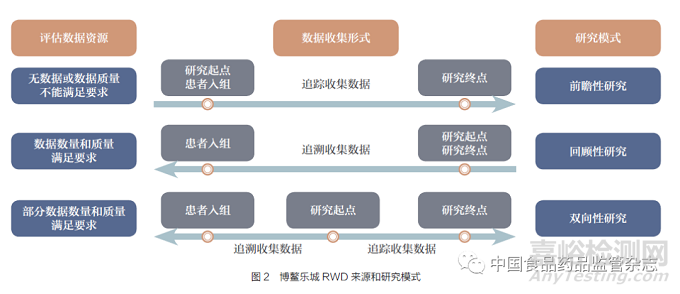
目前,通过特许药械的遴选,博鳌乐城特许药械RWD 研究采用分批试点的形式,某些特许药械产品在进行RWD 研究前已在博鳌乐城医疗机构落地使用,积累了部分数据。根据特许药械RWD 的数量和质量,基于数据收集的形式,博鳌乐城RWD 研究通常采用3 种模式,包括前瞻性研究、回顾性研究、双向性研究( 图2)[17]。在研究开始时,若使用特许药械的患者数量和质量满足临床评价要求,采用回顾性研究模式;若仅有部分数据的数量和质量满足临床评价要求,需前瞻性收集部分患者数据,采用双向性研究模式[18-19] ;若未有患者使用该特许药械,或者数据质量不能满足临床评价要求,需前瞻性收集所有患者用于临床评价,采用前瞻性研究模式。
3 特许药械RWD 研究的关键设计考虑
总体而言,RWD 研究的设计主要包括实效性临床试验和观察性研究[11,20]。但相较于传统的RWD 研究,博鳌乐城特许药械RWD 研究设计类型存在多样性。一方面在于特许药械RWD来源的多样性,如包括患者在居住地医疗机构就诊和随访的数据、博鳌乐城特许药械真实临床干预数据、国外既有的RWD 等。另一方面基于特许药械上市申请对证据的需求,博鳌乐城特许药械已在国外开展相关的临床研究,包括随机对照临床试验和(或)RWD 研究。此外,在特许药械用于上市申请时,还应考虑既有研究证据的质量。
参考国内外监管部门发布的RWD 研究指导原则或规范,结合博鳌乐城特许诊疗政策和团队前期研究经验,博鳌乐城RWD研究的设计包括单组目标值的实效性试验或观察性研究、设立平行对照或历史对照的观察性研究、基于外对照的实效性临床试验、实效性临床试验等[7]。
4 综合研究型数据库构建
常规RWD 采集模式中,基于既有健康医疗数据的综合研究型数据库[15] 和单一研究型注册登记数据库[13] 应用更为广泛。博鳌乐城特许药械RWD 采集,因患者“一地就医,异地随访”的特殊诊疗模式,以及数据载体的复杂多元化,仅依靠回顾性数据(如电子病历数据)往往无法满足实际研究需求,需在统一标准的数据库框架下整合既有健康医疗数据与主动收集数据,达到RWD与博鳌乐城特殊诊疗环境的深度融合[21]。
博鳌乐城特许药械综合研究型数据库构建流程如下:①数据收集方案:明确该数据库所需包含的完整变量信息,明确数据库所需横向链接的数据来源, 明确“ 回顾性+ 前瞻性” 的数据采集方式。② 数据治理:对既有健康医疗数据通过人工提取和(或)自然语言处理等信息技术进行变量筛选提取、质量控制及多源数据库链接等数据治理处理。③数据管理:根据既有数据资源评估结果进行患者招募随访和关键缺失变量的前瞻性采集补充等数据管理处理。④数据标准化:遵循临床数据交换标准协会(CDISC)、《监管活动医学词典》(MedDRA)以及数据完整性标准(ALCOA+CCEA 原则)等数据管理/ 治理标准,提高综合研究型数据库的规范性和可读性,形成标准RWD,同时应重点兼顾治理后数据与前瞻性主动收集数据的内部一致性[22]。
5 博鳌乐城研究案例
特许医疗器械RWD 研究:“青光眼引流管”的注册上市是博鳌乐城开展特许药械RWD 应用试点工作的重要成果。青光眼引流管是用于降低眼压,同时达到减少用药的目的,该产品于2019年5 月在博鳌乐城完成首例手术,2019 年8 月提交真实世界数据收集方案和产品优势介绍等资料进入第1 批真实世界数据研究试点遴选。2019 年12 月,该研究组织了临床专家、RWD 研究专家、数据管理/ 治理团队与海南省药监局的项目讨论会,以保障研究方案和实施过程符合监管的要求。通过分析该研究,从框架和体系的角度分析发现有以下几个特点:①建立多学科研究团队:在研究开始,组建了一支由临床专家、RWD 研究专家、数据管理/ 治理团队等构成的多学科交叉团队,其中临床专家来自温州医科大学附属眼视光医院,对研究所涉及的临床研究指标和患者纳入排除标准给予了建议;RWD研究专家来自四川大学华西医院中国循证医学中心孙鑫教授研究团队,对研究方案的整体框架、研究设计、数据库构建和统计分析给予了具体的技术指导。②创新研究设计模式:在研究开始时,青光眼引流管已经在博鳌乐城先行先试,已有部分患者存在临床诊疗数据。经过评价,已有的5例患者数据质量符合临床研究要求,最终采用了双向性的观察性研究设计。③构建患者登记数据库:为充分利用患者居住地就诊数据、博鳌乐城医疗机构干预数据、居住地随访数据等数据资源,构建了电子患者登记数据库。由于眼科疾病通常发生于双眼,而眼科疾病真实世界数据研究有效性评价需要考虑同一患者的相关性,需要确定一只眼睛作为研究眼,研究眼的确定需与临床专家讨论统一的标准,即在数据收集的时候就分为研究眼和对侧眼收集数据。④整合博鳌乐城特许药械RWD 研究证据和国外已有临床研究证据:青光眼引流管的既有临床评价证据主要包括美国P13-003 随机对照临床试验(randomized controlled trial,RCT)证据和2 篇文献报道包含的中国患者数据[23-24]。文献报告了国外已有临床研究证据人群的相关情况,采用贝叶斯荟萃分析[25],整合国外RCT 证据和2 篇文献证据,对博鳌乐城真实世界研究数据进行纵向建模分析[26]。
6 小结
基于特许政策支持,博鳌乐城在我国药械RWD 研究中具有不可替代的地位与优势,也面临着机遇与挑战:①博鳌乐城特许药械RWD 研究的顺利开展,依托于多学科专家的通力合作。②博鳌乐城特许药械的数据来源广泛且证据产生多元,增加了研究模式、数据库构建和研究设计的多样性。③特许药械上市前,临床评价证据已包括国外既有临床评价证据和博鳌乐城RWD 的研究证据,研究设计的选择既要考虑既有证据的质量,也要考虑统计分析方法中多元证据的整合方法。当前,博鳌乐城RWD 研究还处于不断探索的阶段,很多研究方法、理论创新还需要与实践研究结合起来,RWD 的研究方法学体系也在不断完善。未来,博鳌乐城会进一步加速特许创新药械上市进程,惠及广大患者。
引用本文
姚明宏,任燕,贾玉龙,王雨宁,谭婧,王雯,李玲,徐嘉悦,熊益权,林凯,李耀华,魏春敏,朱宁*,孙鑫*.构建基于特许药械政策的真实世界数据研究模式[J].中国食品药品监管.2021.11(214):14-19.
构建基于特许药械政策的真实世界数据研究模式
Developing Real-World Research Pattern Based on Special Drug and Medical Device Policies
并列第一作者简介
姚明宏,四川大学华西医院中国循证医学中心、国家药监局海南真实世界数据研究与评价重点实验室。专业方向:基于真实世界数据的药械临床评价
并列第一作者简介
任燕,四川大学华西医院中国循证医学中心、国家药监局海南真实世界数据研究与评价重点实验室。专业方向:基于真实世界数据的药械临床评价
通讯作者
孙鑫,教授,国家药监局海南真实世界数据研究与评价重点实验室主任、四川大学华西医院中国循证医学中心主任。专业方向:临床流行病学与循证医学、真实世界数据研究、药械和中医药临床研发评价与监管科学研究、数字医疗产品研发与评价
朱宁,海南省药品监督管理局党组书记、局长。专业方向:医疗器械监管

来源:中国食品药品监管杂志


