您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-11-25 11:59
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
百济神州TYK2变构抑制剂上Ⅰ期临床。百济神州自主研发的TYK2变构抑制剂BGB-23339在国际Ⅰ期临床(NCT05093270)中首例受试者给药。该试验预计将在澳大利亚和中国入组至多115名健康受试者,评价BGB-23339的安全性、耐受性、药代动力学及初步活性。在临床前研究中,BGB-23339已展现出高度选择性,能强效抑制在免疫诱导中起关键作用的促炎细胞因子白细胞介素(IL)-12、IL-23 和 1 型干扰素(IFN)。
国内药讯
1.甲磺酸伏美替尼拟纳入突破性治疗品种。艾力斯医药第三代EGFR-TKI甲磺酸伏美替尼片获CDE拟纳入突破性治疗品种,拟用于一线治疗EGFR外显子19缺失或外显子21(L858R)置换突变的局部晚期或转移性非小细胞肺癌。该新药此前已在国内获批用于治疗既往经EGFR酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展、并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌成人患者,商品名为艾弗沙。
2.恒瑞SHR-1701启动宫颈癌III期临床。恒瑞医药PD-L1/TGFβ双功能融合蛋白SHR-1701登记启动一项III期临床,联合化疗及贝伐珠单抗类似药BP102一线治疗宫颈癌患者。SHR-1701可促进效应性T细胞的活化,同时有效改善肿瘤微环境中的免疫调节作用,最终促进免疫系统对于肿瘤细胞的杀伤。该疗法目前已在国内启动针对宫颈癌、非小细胞肺癌、胃癌等16项临床,是全球研发进度第二的PD-L1/TGFβ双靶点药物,首款为默克的M7824。
3.康宁杰瑞KN046获批胰腺癌Ⅲ期临床。康宁杰瑞PD-L1/CTLA-4双抗KN046获国家药监局临床试验默示许可,拟联合白蛋白紫杉醇与吉西他滨开展用于治疗晚期胰腺癌的Ⅲ期注册临床研究(KN046-303)。该项临床研究计划入组408例受试者,评估KN046联合白蛋白紫杉醇与吉西他滨对比安慰剂联合白蛋白紫杉醇与吉西他滨的疗效和安全性。主要研究终点为经IRC评估的无进展生存期(PFS)和总生存期(OS)。
4.再鼎多激酶抑制剂获批实体瘤临床。再鼎医药1类新药TPX-0022胶囊获国家药监局临床试验默示许可,拟临床用于MET基因变异的局部晚期或转移性非小细胞肺癌、胃癌或实体瘤的治疗。TPX-0022是Turning Point Therapeutics开发的一款口服MET/CSF1R/SRC激酶抑制剂,再鼎拥有该药在大中华区的开发和商业化的独家授权。今年6月和8月,TPX-0022分别获FDA授予快速通道和孤儿药资格,用于胃癌治疗。
5.泽纳生物获得CD19双抗的全球权益。泽纳生物与Xencor公司达成合作协议,以总价4.8亿美元获得后者CD19双抗Obexelimab开发、制造和商业化的全球独家权益。Obexelimab是一款潜在FIC人源化CD19双功能抗体,可通过XmAb免疫抑制因子Fc结构域靶向结合FcγRIIb,进而影响B细胞功能。该新药可在不消耗细胞的情况下有效抑制B细胞功能,拟用于治疗多种自身免疫性疾病。
国际药讯
1.创新mTOR抑制剂获FDA批准上市。FDA批准Aadi Bioscience公司创新mTOR抑制剂Fyarro(ABI-009)上市,用于治疗局部晚期/转移性恶性血管周上皮样细胞肿瘤(PEComa)。在一项Ⅱ期临床中,Fyarro的总缓解率达到39%;试验的中位缓解持续时间尚未达到,中位随访时间为36个月。Fyarro也是FDA批准用于治疗这类患者的首款药物。亿腾景昂公司拥有该药在大中华区的独家开发和商业化权利。
2.武田新机制抗病毒疗法获FDA批准上市。FDA批准武田开发的pUL97激酶抑制剂Livtencity(maribavir,TAK-620)上市,用于治疗接受造血干细胞移植或实体器官移植后12岁以上患者的难治性巨细胞病毒(CMV)感染。这是获FDA批准针对这类患者的首款疗法。在一项Ⅲ期临床中,与活性对照组相比,Livtencity治疗组8周后CMV的DNA水平检测不到的患者比例更高(56%vs24%)。
3.BMS口服激酶抑制剂获英国NICE批准。百时美施贵宝口服激酶抑制剂Inrebic(fedratinib)获英国国家卫生与临床优化研究所(NICE)批准纳入国家医疗服务系统(NHS),用于骨髓纤维化的治疗。Inrebic被推荐在癌症药物基金(CDF)范畴内,用于先前曾接受过ruxolitinib(鲁索替尼)治疗的原发性骨髓纤维化、真性红细胞增多症后骨髓纤维化、原发性血小板增多症后骨髓纤维化成人患者。
4.阿斯利康新冠中和抗体两项III期临床积极。阿斯利康新冠长效抗体组合疗法AZD7442( tixagevimab和cilgavimab)用于有症状COVID-19的暴露前预防的III期临床PROVENT结果积极。6个月随访数据显示,一次性肌肉注射AZD7442使症状性 COVID-19风险降低83%。该疗法在用于轻中症COVID-19门诊患者的III期临床TACKLE同样取得积极结果,在出现症状3天内治疗的患者中,AZD7442 600 mg IM降低重症COVID-19或死亡风险88%。临床中AZD7442耐受性良好。
5.罗氏CD20/3双抗治疗血癌关键临床结果积极。罗氏CD20/CD3双抗mosunetuzumab治疗复发/难治性滤泡性淋巴瘤的关键性临床结果积极。mosunetuzumab单药治疗的客观缓解率达到78.9%,完全缓解率达到57.8%。中位无进展生存期为17.9个月。不良事件多为细胞因子释放综合征(44%),大部分为1级或2级。详细结果将在ASH2021会议上公布。该公司计划在年底前递交监管申请。
6.再生元布局创新DNA疫苗。Nykode公司与再生元将利用前者模块化Vaccibody技术平台,合作发现、开发和商业化5款新型DNA疫苗,以治疗癌症与预防传染病。Vaccibody分子由三个功能单位组成:与抗原提呈细胞表面受体结合的靶向单位、二聚化单位和来源于致病因子(癌细胞或病原体)的抗原单位。根据协议,Nykode将获得3000万美元的预付款和2000万美元的股权投资,超过8.75亿美元的里程碑付款以及产品的销售分成。
7.美国签订协议采购辉瑞新冠口服药。辉瑞宣布已与美国政府就其口服抗新冠病毒药物Paxlovid签订采购协议。辉瑞已在11月16日向FDA递交该药物紧急使用授权申请(EUA),如果获批,美国政府将采购1000万个疗程的Paxlovid,总共将支付52.9亿美元,对应一个疗程为529美元(约3378元人民币)。Paxlovid是一种SARS-CoV-2-3CL蛋白酶抑制剂PF-07321332与低剂量抗病毒药利托那韦的复方制剂,可使高危新冠患者的住院和死亡风险减少89%。
医药热点
1.15省份开展老年医疗护理服务试点工作。国家卫健委日前印发通知,宣布在北京市、天津市、山西省、吉林省、上海市、江苏省、浙江省、安徽省、山东省、湖北省、广东省、广西壮族自治区、海南省、四川省和陕西省,开展老年医疗护理服务试点工作。试点任务包括增加提供老年医疗护理服务的医疗机构和床位数量;加强老年医疗护理从业人员培养培训;增加多层次老年医疗护理服务供给;创新多元化老年医疗护理服务模式等。
2.吉林省肿瘤医院设立早癌免费筛查开放日。吉林省肿瘤医院健康体检中心日前推出惠民服务新举措,确定每周三为“早癌免费筛查开放日”。每周三的开放日,将为年龄45岁至74岁本市常住人口、无肿瘤病史人群,开展肿瘤高危因素问卷调查、生物学检测、早癌高危因素评估、健康科普宣教等服务。
3.澳门新冠灭活疫苗接种年龄降至3岁。澳门新冠病毒感染应变协调中心日前宣布调整新冠灭活疫苗接种年龄,下调至年满3岁起即可预约接种。自11月23日起,家长或其他监护人可为相关人士预约接种。而mRNA新冠疫苗则继续适用于年满12岁人士接种。该协调中心同时强调,未满18岁人士接种新冠疫苗,须取得其家长或其他监护人同意。
4.科学家研制出一种抗新冠口香糖。发表在《Molecular Therapy》上的一项最新研究显示,来自美国宾夕法尼亚大学的研究团队研发出一种可以捕获新冠病毒颗粒的实验性口香糖。该口香糖含有ACE2受体,咀嚼它不仅能限制唾液中的病毒载量,还有助于遏制感染病毒者在说话、呼吸或咳嗽时的传播病毒。据悉,通过咀嚼口香糖使样本中的病毒载量减少了95%以上。
评审动态
1. CDE新药受理情况(11月24日)
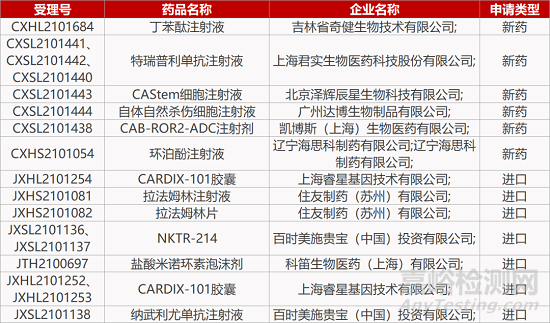
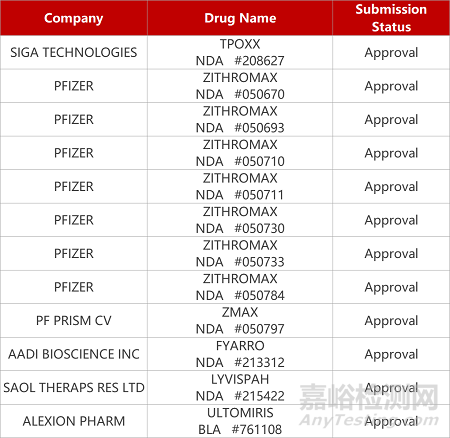

来源:药研发


