您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-09-14 21:01
近日,为进一步推动医疗器械唯一标识(以下简称“UDI”)工作实施,指导医疗器械生产企业开展UDI赋码、数据申报等工作,深圳市市场监督管理局组织制定了《基于GS1标准的国内UDI系统实施指引》。具体如下:
基于GS1标准的国内UDI系统实施指引
对于注册人/备案人,UDI系统实施流程如下:
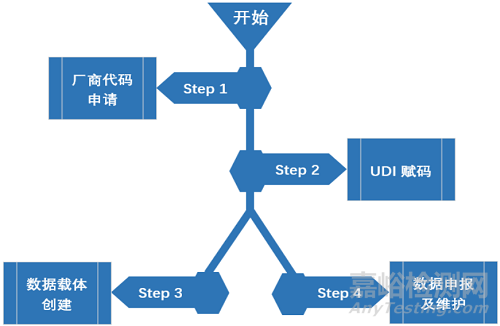
从流程图可以看出,对于注册人/备案人UDI系统的两个基本的输出是:
1) 提供附有UDI数据载体的器械;
2) 在UDI数据库上申报及维护UDI数据。
Step 1 厂商识别代码申请
厂商识别代码需要向编码机构申请,GS1的厂商识别代码可以在网上申办,办理渠道如下,任选其一:
1) 网上登录http://wsdt.gs1cn.org/anccoh/login.jsp办理;
2) 关注中国物品编码中心官方公众号“中国编码”,后点击业务办理即可通过微信办理和查询业务,获取业务办理进度提醒。
3) 下载中国物品编码中心官方软件“中国编码”app,快速申请商品条码。
Step 2 UDI赋码
UDI赋码是确定器械产品标识(DI)和生产标识(PI)的活动,包含DI赋码和PI确定。
UDI应当符合唯一性、稳定性和可扩展性的要求。
1) 唯一性,是指医疗器械唯一标识应当与医疗器械识别要求相一致。
2) 稳定性,是指医疗器械唯一标识应当与产品基本特征相关,产品的基本特征未变化的,产品标识应当保持不变。
3) 可扩展性,是指医疗器械唯一标识应当与监管要求和实际应用不断发展相适应。
2.1 UDI赋码准备
梳理器械(包括医疗附件和医用耗材)可销售产品清单,明确公司当前用于营销、商务、生产和研发识别可销售产品的标识,例如产品型号、规格、货号、REF、物料编码等。这个标识应作为锚定基准,作为DI赋码的基础。
梳理器械销售产品和可销售单元清单,明确销售单元和上述产品标识之间的关系。
梳理器械当前标签中的追溯要素(一般包含序列号、生产批号、生产日期、失效日期这四种中一个或多个),这些追溯要素构成了器械的PI种类。不需要为UDI合规增加新的追溯要素。
2.2 DI赋码
DI是连接内外部产品标识的桥梁,是静态数据。按照2.1节梳理的产品可销售单元清单,每个符合医疗器械定义的可销售单元均应分配一个唯一的DI。例如试剂、耗材产品按照每个销售规格分配DI,有源医疗器械一般属于可配置器械,可以按照产品型号或货号分配DI。
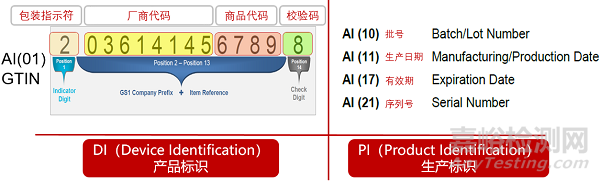
根据GS1标准,DI码的数据结构是14位数字,由包装指示符、厂商识别代码、商品代码、校验码四个部分组成。具体请见附录1.2。
厂商识别代码由编码机构(中国物品编码中心)分配(本指引Step 1),包装指示符和商品项目代码由企业结合产品及包装形态自定义,校验码是根据其它三个部分的具体值按照固定的公式(具体请见GB 12904《商品条码 零售商品编码与条码表示》)计算得出,也可借助中国物品编码中心官方网站上的校验码工具计算。所以此处DI赋码的实质是确定包装指示符和商品项目代码。
DI赋码规则请见附录2。
2.3 PI确定
PI(生产标识)由医疗器械生产过程相关信息的代码组成,根据监管和实际应用需求,可包含医疗器械序列号、生产批号、生产日期、失效日期等。
注册人/备案人应把同级标贴或者包装上的医疗器械序列号、生产批号、生产日期、失效日期转化为PI信息。PI是根据同级标贴的相关信息转化而来的动态数据,需根据特定、具体的产品确定。
UDI载体的内容应与标签的相应内容一致。
对于按照批次管理的医疗器械,如需标识到单个产品,序列号可由批号和序列编码共同组成,DI与序列号的组合的应保持唯一。
PI各要素的排列,应保持定长要素在前,不定长要素在后。
根据GS1标准,各种PI编码的数据结构及应用标识符参见GB/T 16986《商品条码 应用标识符》。
Step 3 数据载体创建
UDI数据载体是指存储或者传输医疗器械唯一标识的数据媒介,应当满足自动识别和数据采集技术(机器识读,AIDC)以及人工识读(HRI)的要求。常见的机器识读载体形式有一维码、二维码、RFID。
创建UDI数据载体包括确定编码形式以及在产品上的呈现形式。
取决于企业特点和运行效率,UDI标签可以单独设计,也可以融合到原有产品标签中。无论采用哪种形式,UDI的编码和载体均应满足所选择的UDI编码标准,才能确保下游客户能够识别。
根据GS1标准,UDI数据载体的具体编码形式应符合GS1相关标准要求。具体可查阅GS1官方网站和中国物品编码中心网站。
GS1官网:https://www.gs1.org/
中国物品编码中心官网:http://healthcare.ancc.org.cn/webhug/UDI/page1.html
UDI数据载体具体要求请见附录3。
Step 4 数据申报及维护
注册人/备案人应当在产品上市销售前,将产品标识和相关数据上传至医疗器械唯一标识数据库,并对数据的真实性、准确性、完整性负责。
UDI数据申报可参阅国家药品监督管理局医疗器械唯一标识数据库发布的服务指南。
医疗器械唯一标识数据库网址:https://udi.nmpa.gov.cn
附录1-UDI系统介绍
1. UDI系统简介
UDI系统包括医疗器械唯一标识(unique device identifier,简称UDI)、UDI数据载体、UDI数据库三个方面。
2. UDI编码
医疗器械唯一标识(UDI),是指在医疗器械产品或者包装上附载的,由数字、字母或者符号组成的代码,用于对医疗器械进行唯一性识别。
UDI由产品标识(DI)和生产标识(PI)组成,其规则应该符合被认可的编码机构的标准。
GS1 标准的UDI构成如下图。
UDI结构图
注1:DI必须为14位数据字符串,小于14位的GTIN必须在开头填充零作为补位。
注2:厂商识别代码长度一般7-9位,厂商识别代码长度+商品代码长度=12位。按照GS1标准,DI即GTIN,构成DI的14位数字中,第一位包装指示符由企业根据业务需求分配。例如,同一个产品多种包装数量时,包装指示符用0补位,每种包装形式在“商品代码”中进行分配;也可以保持“商品代码”不变,通过变更包装指示符的方式来体现不同DI,不同级别包装指示符可采用1-8。
3. UDI数据载体
UDI数据载体是指存储或者传输医疗器械唯一标识的数据媒介,应当满足自动识别和数据采集技术(机器识读)以及人工识读的要求。常见的机器识读载体形式有一维码、二维码、RFID。
4. UDI数据库
UDI数据库是指储存医疗器械唯一标识的产品标识与关联信息的数据库。
5. 相关术语
医疗器械包装(Medical Device Package)
是指本身属于贸易项目,包含固定数量的特定版本或型号医疗器械的包装。
主产品标识(主DI,UDI-DI)
最低级别医疗器械包装的产品标识,其是UDI数据库管理的基本单元。
注:
a) 最低级别医疗器械包装通常也是最小销售单元。
b) 对于单个独立包装的器械,最低级别医疗器械包装内的器械数量是1。
c) 对于器械数量不为1的包装,如果内含不同数量器械的包装之间没有构成层级关系,那么这些包装都是最低级别医疗器械包装;如果内含不同数量器械的包装之间有层级关系,那么有层级关系的包装中器械数量最少的那个包装就是最低级别医疗器械包装。
使用单元产品标识(unit of use device identifier;UoU UDI-DI)
在医疗器械使用单元上没有医疗器械唯一标识的情况下,分配给单个医疗器械产品的产品标识,其目的是关联患者和医疗器械。
[来源:YY/T 1681-2019,定义3.5]]
包装产品标识(包装DI,PUDI-DI)
是指最低级别医疗器械包装之上的更高级别包装单元的产品标识。
本体唯一标识(本体UDI,DM UDI)
通过某种技术手段把器械唯一标识的数据载体直接永久性地标记在器械本体上,此唯一标识叫做本体唯一标识。
注:YY/T 1681-2019中有关本体直接标识(direct marking)的定义:在医疗器械本体上永久附加医疗器械唯一标识的方式。
本体产品标识(本体DI,DM DI)
是指本体唯一标识的产品标识。
包类器械
是指由两个或以上医疗器械因特定的医疗目的而组合在一起包装的医疗器械组合包。
可配置器械
是指由多个部件组成的可以以多种配置组装的医疗器械。可配置器械可以分开包装也可以一起包装,组成可配置器械的部件/附件本身也可以是医疗器械。
运输包装
由物流系统过程控制产品可追溯性的包装。
一般运输包装内医疗器械品种或数量可能随运输目的地不同而不同。
附录2-DI赋码规则
1. DI创建
a) 应为最低级别医疗器械包装单元及各更高级别包装单元创建DI,各级别包装单元的DI应保持唯一。
b) 应为使用单元创建DI。
c) 对于可配置器械,应为可配置器械创建DI,可配置器械中的所有配置组合使用同一DI,应为可单独销售的医疗器械部件/附件创建不同的DI。
d) 对于包类器械,应为包类器械创建DI,应为包内可单独销售的器械创建不同的DI,应为内含器械品类和数量不同的包类器械创建不同的DI。
e) 对于试剂产品,应为成品试剂的不同包装规格创建不同的DI。
f) 本体DI可以与主DI相同,也可以不同。
g) 运输包装可豁免UDI要求。
2. DI更新
a) 产品发生可能影响医疗器械识别、追溯的变更或者监管要求变化时,应当创建新的产品标识。
b) DI更新规则应当符合法规要求和UDI数据库的更新要求。
c) 包装内的器械品类和数量发生改变,应当创建新的DI。
附录3-UDI数据载体要求
通用要求
UDI载体应在正常使用和预期使用期限内是可识读的,并且要保持在使用、存储、运输中是易于识读的。
载体构成
载体由机器识读部分和人工识读部分组成。如空间有限或者使用受限,应当以机器识读优先。
若采用RFID作为数据载体,应同时具备一维码或二维码。
若采用一维码作为数据载体,载体可以分行。
载体呈现
UDI数据载体应放置在器械标贴和包装以及所有更高级别的包装上,或者本体上,若使用单元标贴和包装存在空间限制或者技术上不可行,UDI载体可放置在更高级别的包装上。
1) 对于可配置器械,UDI载体应放置在最不可能被替换的组成部件的标贴上。如果是分开包装,在易于识别的前提下,UDI载体可放置在任何一个包装上。
2) 对于使用前需要灭菌的可重复使用器械,UDI载体应放置在器械本体上,并确保处理后是可识读的。
3) 对于医疗器械独立软件,软件界面中应包含UDI,可仅包含人工识读部分。有物理介质的,物理介质上应放置UDI载体,且载体上的DI与软件界面中的DI应保持相同。
4) 在技术可行且不影响器械安全、有效性的情况下,鼓励在使用单元上应放置UDI载体。
5) 唯一标识数据载体应保持相对独立,HRI部分应排列在AIDC部分的附近,避免与其它数据载体信息相混淆。
如下是UDI载体的例子。
例 有源产品(可配置器械)
该产品按照产品型号赋DI码,原标签上通过生产日期和序列号进行追溯,因此PI也包括生产日期和序列号。
为了避免对现有标贴产生冲击,单独加贴了一个二维码标贴。
该产品DI码是06944904096674(括号里01是GS1标准下的GTIN应用标识符,表示01后面的数字是DI)。PI由两部分组成:生产日期(200528是生产日期,括号里的11是GS1标准下的“生产日期”应用标识符)和序列号(AA6-05005374是产品序列号,括号里的21是GS1标准下的“序列号”应用标识符)。


来源:深圳市市场监督管理局


