您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-13 20:58
前 言
遗传毒性试验评估什么?
遗传毒性试验是采用哺乳动物或非哺乳动物细胞、细菌、酵母菌、真菌或整体动物测定试验样品是否会引起基因突变,染色体结构畸变以及其他DNA或基因变化的试验。
遗传毒性试验主要用于检测两类主要的遗传损伤,一类是基因突变(点突变);另一类是染色体损伤评价,例如染色体结构畸变,染色体缺失和插入,染色体数目畸变。经过验证,体外哺乳动物染色体畸变试验和体外小鼠淋巴瘤TK试验得到一致的结果,但这两项试验结果一致认为有遗传毒性的化合物在细菌回复突变试验中却产生阴性的结果。该项试验结果表明,单一的试验无法检测出所有相关遗传物质,因此通常进行一组体外试验。标准的遗传毒性试验组合中,体外哺乳动物染色体畸变试验和体外小鼠淋巴瘤TK试验中任何一个与细菌回复突变试验组合,当前监管机构都认为是可以接受的。
哪些医疗器械需要进行遗传毒性评价?
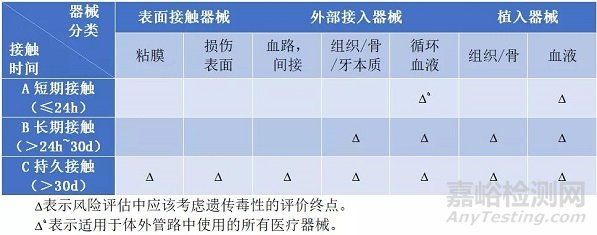
体外遗传毒性试验常用的为细菌回复突变试验,体外哺乳动物染色体畸变试验和体外小鼠淋巴瘤细胞TK试验。接下来将一一介绍。
染色体畸变试验简介
试验目的和原理
通过检测受试物是否诱发体外培养的哺乳类细胞染色体畸变,评价受试物致突变的可能性。在加入和不加入代谢活化系统的条件下,使培养的哺乳类细胞暴露于受试物中。用中期分裂阻断剂(如秋水仙素)处理,使细胞停止在中期分裂相,随后收获细胞、制片、染色、分析染色体的畸变。
染色体畸变试验测试方法
预实验
对怀疑有细胞毒性反应的试验样品应进行预实验。宜在有或无代谢活化的情况下,使用相对群体倍增数(RPD)或者相对细胞增长数(RICC)来评估样品的细胞毒性,以保证有足够数目的细胞处于有丝分裂状态。
当试验样品具有细胞毒性时,应以试验样品或浸提原液作为最高浓度组进行稀释,即实验用最高浓度与阴性对照相比RPD或RICC达到(55±5)%的浓度。测试一般选用3个测试浓度。
正试验
试验分为短期处理组(有和无代谢活化系统)和长期处理组(无代谢活化系统)。短期处理组是使用处于对数生长状态的细胞与试验样品、对照样品分别在有代谢活化系统和无代谢活化系统的情况下接触处理3-6小时,接触后使用PBS清洗细胞3次,加入新鲜培养基继续培养,并在接触开始后约1.5倍细胞正常周期时收获细胞。长期处理组是使用处于对数生长状态的细胞与试验样品、对照样品在无代谢活化系统的情况下接触处理约1.5倍细胞正常周期,然后收获细胞。收获细胞前1-3小时加入细胞分裂中期阻断剂秋水仙素,使其终浓度在0.1µg/ml~1µg/ml。收获细胞时,先使用胰蛋白酶消化细胞,然后将细胞放在氯化钾溶液中进行低渗,低渗的目的是使细胞充分膨胀,易于在滴片的时候破裂。低渗后的细胞使用固定液进行反复固定,然后滴片、染色并观察。一般每组至少评估300个处于中期分裂的细胞,记录染色体畸变的细胞数,计算染色体畸变率。
染色体畸变试验接受标准
质控接受标准:
a)阴性对照应在历史阴性对照数据库95%的控制限值范围内;
b)阳性对照应在历史阳性对照数据库95%的控制限制范围内,阳性对照与阴性对照相比应具有统计学显著性增加。
阳性结果:
满足质控标准下,试验成立,若出现下列情况可判定试验样品呈阳性:
a)与阴性对照相比,染色体结构畸变率在统计上显著地增加;
b)如存在多剂量组试验时,当用适当的浓度梯度测试进行评估时存在与剂量相关的增加;
c)任一组结果超出了历史的阴性对照数据的分布范围(例如,95%的控制限值)。
当满足上述所有这些标准时,认为试验样品在本试验系统下具有致哺乳动物细胞染色体畸变性。
体外小鼠淋巴瘤TK试验简介
什么是体外小鼠淋巴瘤TK试验
体外小鼠淋巴瘤TK试验是一种哺乳动物体细胞基因正向突变实验,近年来其应用价值有明显的提高。TK基因突变的检测终点是胸苷激酶(TK)基因的突变。人类TK基因定位于17号染色体长臂远端;小鼠定位于11号染色体。TK基因突变属于常染色体基因突变。
体外小鼠淋巴瘤TK试验的目的及原理
TK基因突变的产物胸苷激酶在体内催化从脱氧胸苷(TdR)生成胸苷酸(TMP)的反应。在正常情况下,此反应并非生命所必须,原因是体内TMP主要来自于脱氧尿嘧啶核苷酸(dUMP),即由胸苷酸合成酶催化的dUMP甲基化反应生成TMP。但如果在细胞培养物中加入胸苷类似物(如三氟胸苷,即trifluorothymidine,TFT),则TFT在胸苷激酶的催化下可生成三氟胸苷酸,进而掺入DNA,造成致死性突变,故细胞不能存活。若TK基因发生突变,导致胸苷激酶缺陷,则TFT不能磷酸化,亦不能掺入DNA,故细胞在含有TFT的培养基中能够生长,即表现出对TFT的抗性。根据突变集落形成数,可计算突变频率,从而推断受试物的致突变性。
细胞系的选择
标准推荐选用L5178Y TK+/--3.7.2C细胞系。当试验细胞系平均自发突变频率超出50×10-6~170×10-6范围时,需要对自发突变细胞进行清除。使用THMG培养基培养24h,200g离心5min,再用THG培养2天。
体外小鼠淋巴瘤TK试验的检测方法
预实验:
当怀疑试验样品具有细胞毒性时,以试验样品或浸提原液作为最高浓度组进行梯度稀释,最高的试验浓度应为相对存活率在10%~20%的浓度,梯度稀释宜包括从中到小或无细胞毒性的浓度范围。
主试验:
与染色体畸变试验相同,同样分为短期处理组(有和无代谢活化系统)和长期处理组(无代谢活化系统)。有活化系统与细胞悬液和试验样品(浸提液)及S9混合液组成,无代谢活化系统由细胞悬液和试验样品(浸提液)及PBS组成。然后将混合液置于37℃振荡培养4h,后用无血清培养基洗涤细胞两次,然后用培养基重悬。部分用于接种平板,每种剂量两块平板,置于37℃培养10d~12d。部分继续进行表达,表达2天,然后接种平板,分为PE2平板接种与TFT平板接种,每种剂量同样接种两块平板,置于37℃培养10d~12d。
体外小鼠淋巴瘤TK试验的质控标准
阴性对照组:平板效率为65%~120%,突变频率MF应为50×10-6~170×10-6;
阳性对照组:至少满足以下两个标准中的一个标准则试验有效,否则应重新试验:
1)阳性对照MF与阴性对照有显著性差异,比阴性对照高300×10-6以上,其中阳性对照的小集落突变频率应占40%以上。
2)阳性对照的小集落突变频率比阴性对照高150×10-6以上。
体外小鼠淋巴瘤TK试验的结果判定
试验组MF与阴性对照组有显著性差异,且超过GEF(126×10-6)以上并具有重现性,则可判定检测结果阳性。
试验组MF与阴性对照组没有显著性增长,或有增加但小于GEF(126×10-6),则可判定检测结果阴性。
细菌回复突变试验简介
试验目的和原理
细菌回复突变试验是检测受试物对于微生物(细菌)的基因突变作用,预测其潜在的遗传毒性。
细菌回复突变试验利用鼠伤寒沙门氏菌组氨酸营养缺陷型菌株来检测点突变。这类菌株本身不能合成组氨酸,故在缺乏组氨酸的培养基上,仅有少数自发回复突变的细菌生长。假如有致突变物存在,则营养缺陷型菌株会回复突变成野生型,故在缺乏组氨酸的培养基上能生长形成菌落。故可以根据菌落形成的数量判断受试样品中是否存在致突变物。某些致突变物需要代谢活化后才能引起回复突变,故需要同时在存在和没有代谢活化协同的条件下进行试验。
试验菌株
至少应使用五种菌株。推荐使用以下菌种组合:
1) 鼠伤寒沙门氏菌TA1535;
2) 鼠伤寒沙门氏菌TA97a或TA97或TA1537;
3) 鼠伤寒沙门氏菌TA98;
4) 鼠伤寒沙门氏菌TA100;
5) 鼠伤寒沙门氏菌TA102或大肠杆菌WP2uvrA或大肠杆菌WP2uvrA(PKM101)。
测试方法
预实验:
对未知或怀疑对试验菌株有抑制作用的试验样品,应进行预实验。在有或无代谢活化的情况下,用回复突变的菌落数来评估样品是否有细胞毒性,如有抑制作用,则需对试验样品浸提液进行梯度稀释,所选的剂量范围应包括细胞毒性从最大到小或无细胞毒性,一般至少包括5个试验浓度梯度,并以最小或者无细胞毒性的浓度按照平板渗入法进行主试验。
主试验(平板渗入法):
使用移液器将冷冻保存的菌株培养物接种于5mL营养肉汤培养基无菌试管内,在37℃恒温培养箱中培养10-12h至对数增长期,其浓度不少于1×109CFU/ml,培养瓶可用黑纸包裹,以防光线照射细菌。
融化顶层培养基,将融化好的顶层培养基分装于无菌小试管,每管2mL,将试管放入45℃恒温水浴锅中保温。在保温的顶层培养基中依次加入每种菌株的新鲜菌液0.1mL混匀,试验样品组加入浸提液0.1mL,阴性对照组加入0.1mL浸提介质,阳性对照组加入0.1mL诱变剂,活化组加入0.5mL10%S9混合液,未活化组加入0.5mL 0.2mol/L的磷酸盐缓冲液,每个组做3个平行,轻轻混匀后迅速将此混合物倒入已经固化的底层培养基平皿中,转动平皿,使顶层培养基均匀分布,平放固化。全部平皿倒置于37℃培养箱培养48~72h。培养结束后计数并记录每个平皿的菌落数,并计算3个平皿的平均数和标准差。
接受标准
质控接受标准:
阴性对照组细菌回复突变数应在自发回复突变菌落数范围内;
阳性对照组的菌落数应与阴性对照组菌落数存在显著性增加;否则对不在范围内的菌株应重新进行试验。
结果判定:
至少有一个试验菌株,无论在+S9或-S9条件下,试验样品组的细菌回复突变菌落数在一个或多个浓度条件下呈现可重复性的增长,并具有统计学意义的为阳性结果。
结果符合上述标准的试验物质被认为有致突变性。

来源:海河生物


