您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-06-25 20:35
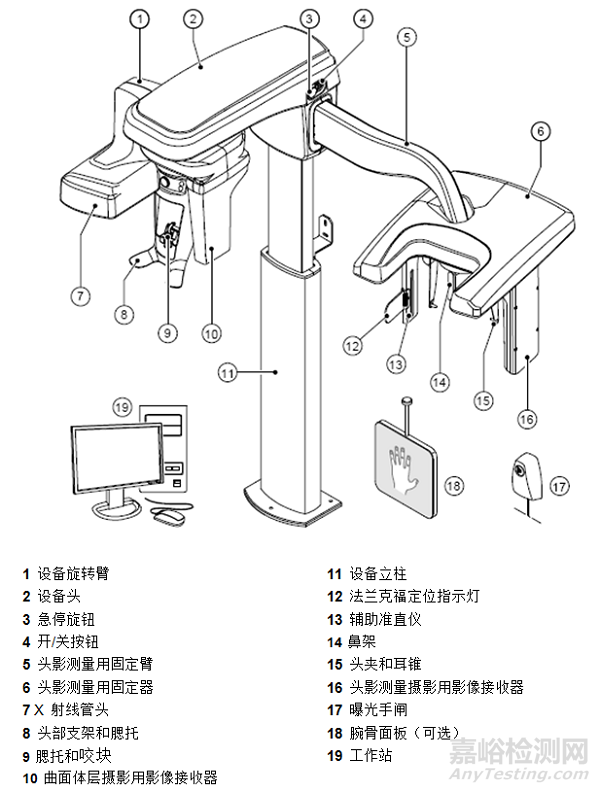
口腔曲面体层X射线机是指通过曲面体层摄影的扫描方式生成曲面体层影像、显示口腔正常组织和病变组织结构的X射线摄影设备,也包括组合头影测量摄影(获得头颅正侧位和/或手腕部的二维影像)的设备。整机布置图如下图所示:
一、口腔曲面体层X射线机的研发实验要求
1.性能研究
(1)应进行曝光条件的研究
产品的曝光条件直接影响成像质量和剂量。应:
①明确产品曝光条件的总体范围,并给出产品曝光条件与成像性能、剂量的对应关系。
②给出针对成人的推荐曝光条件,以及对应的成像性能和剂量;如果产品声称适用于儿童,应给出针对儿童的推荐曝光条件。推荐曝光条件应考虑剂量控制。
在注册检测中,应包括至少一种成人的推荐曝光条件;如果产品声称适用于儿童,还应包括儿童的推荐曝光条件。
(2)临床测量功能的研究
应给出产品可进行的临床测量的项目名称,描述测量方法、临床意义及准确性(如几何尺寸精度)的验证报告。测量项目例如:二维影像范围内的距离测量、角度测量。
(3)产品特点的研究
应描述说明书中声称的新技术,至少包括新技术名称、实现原理;新技术研究的性能和功能;新技术是否改变了临床预期用途;新技术的安全性(可以通过新技术的设计说明书+风险分析报告+临床不良事件+潜在故障的预防措施等加以分析)。应进行新增功能或临床应用的设计规格要求和系统验证或确认研究。
如降低剂量、自动对焦功能、主动降噪功能、单次摄影多层全景等,至少应进行如下研究:
①降低剂量功能,应描述使用该功能与普通模式相比,降低剂量使用的方法,并记性证明剂量降低的研究。
②自动对焦功能,应描述自动对焦实现的原理,并进行证明采用自动对焦后提高图像质量的研究。
③主动降噪功能,应描述主动降噪实现的原理,并进行证明采用主动降噪后提高图像质量的研究。
④单次摄影多层全景功能,应描述单次摄影多层全景实现的原理,并给出验证资料。
(4)剂量的说明
通常选取剂量与面积之积(DAP)、空气比释动能(KERMA)等指标评价设备的剂量。
①设备包含多种摄影模式时,应针对每种摄影模式分别进行评价。
②应描述焦点、X射线照射野尺寸、患者摆位以及影像接收区域的几何关系。
③应明确包括DAP、KERMA等其他剂量指标的测量方法并给出选用该测量方法合理依据。应记录测试过程中使用的曝光条件,包括管电压、管电流、加载时间、限束器(如长矩形、长圆形)、扫描选项(如标准全景、分段全景/部分全景、颞下颌关节)等,并记录发生的剂量值。若曝光条件可调,应给出典型曝光条件的测试值,以及总的剂量范围。
(5)性能指标的确定依据
曲面体层摄影的性能指标和应达到的要求,建议参照YY/T 0010《口腔X射线机专用技术条件》相应条款。
头影测量摄影的性能指标建议参照曲面体层摄影,性能指标试验方法可参考YY/T 0106《医用诊断X射线机通用技术条件》中相应的试验方法修改制定。
2.生物相容性评价研究
与患者皮肤或口腔粘膜直接接触的部分,如头托、颌托、面颊夹、耳夹、咬合叉等;与使用者皮肤直接接触的部分,如控制面板等,均应给出接触部分名称、材料、接触性质(接触类型、接触时间),并应根据GB/T 16886.1《医疗器械生物学评价》系列标准或YY/T 0268《牙科学 口腔医疗器械生物学评价》系列标准进行生物相容性评价。
3.灭菌/消毒工艺研究
应给出关于接触到患者的设备表面的清洁、消毒说明,以及所有可能需要清洁、消毒的设备表面的清洁、消毒说明,以避免交叉感染。
与患者皮肤或口腔粘膜直接接触的应用部件,如头托、颌托、面颊夹、耳夹、咬合叉,需要清洁或消毒。应给出推荐的清洁和消毒方法,推荐使用的试剂,推荐的依据(如《口腔诊疗器械消毒灭菌技术规范》等)以及清洁和消毒效果的验证报告。
4.产品有效期和包装研究
应给出整机的有效期、有效期的确定依据及验证报告,可通过分析影响整机有效期的因素确定整机的有效期。
产品包装应符合YY/T 1099《医用X射线设备包装、运输和贮存》的要求,并给出符合性的自检报告。
二、口腔曲面体层X射线机的相关标准
表1列出本产品主要涉及的现行有效的国家/行业标准。
表1 产品适用的相关标准
|
GB 9706.1—2007 |
医用电气设备 第1部分:安全通用要求 |
|
GB 9706.3—2000 |
医用电气设备 第2部分 诊断X射线发生装置的高压发生器安全专用要求 |
|
GB 9706.11—1997 |
医用电气设备 第2部分 医用诊断X射线源组件和X射线管组件安全专用要求 |
|
GB 9706.12—1997 |
医用电气设备 第1部分 安全通用要求3 并列标准 诊断X射线设备辐射防护通用要求 |
|
GB 9706.14—1997 |
医用电气设备 第2部分 X射线设备附属设备安全专用要求 |
|
GB 9706.15—2008 |
医用电气设备 第1部分 安全通用要求 1.并列标准医用电气系统安全要求 |
|
YY 0505—2012 |
医用电气设备 第1—2部分:安全通用要求并列标准:电磁兼容要求和试验 |
|
GB 7247.1—2012 |
激光产品的安全第1部分:设备分类、要求 |
|
YY/T 0010—2008 |
口腔X射线机专用技术条件 |
|
YY/T 0106—2008 |
医用诊断X射线机通用技术条件 |
|
YY/T 0291—2016 |
医用X射线设备环境要求及试验方法 |
|
YY/T 1099—2007 |
医用X射线设备包装、运输和贮存 |
|
GB 4943.1—2011 |
信息技术设备 安全 第1部分:通用要求 |
三、主要风险
风险管理报告应符合YY/T 0316《医疗器械 风险管理对医疗器械的应用》的有关要求,具体编写可参照《医用X射线诊断设备(第三类)注册技术审查指导原则(2016年修订版》(国家食品药品监督管理总局通告2016年第21号)中附录V 章节“风险管理文档”的要求。

来源:嘉峪检测网


