您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-04-29 09:08
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
慢性肾病新药巴多索隆申报美国上市。FDA受理Reata Pharmaceuticals公司Nrf2激活剂巴多索隆(bardoxolone)的新药申请,用于治疗亚伯氏症(遗传性肾炎)导致的慢性肾病。PDUFA日期为2022年2月25日。在一项Ⅲ期临床CARDINAL试验中,与安慰剂组相比,bardoxolone治疗组患者在第100周和第104周通过eGFR观察到肾功能有统计学上的显著改善。此前,该新药曾获FDA授予孤儿药资格,用于治疗亚伯氏症和常染色体显性遗传性多囊肾病。
国内药讯
1.恒瑞CDK4/6抑制剂SHR6390申报上市。恒瑞1类新药CDK4/6抑制剂SHR6390片的新药上市申请获CDE受理。值得一提的是,该产品近期已被CDE纳入突破性治疗品种和优先审评程序,临床适应症为:联合氟维司群用于HR+、HER2-的经内分泌治疗后进展的复发或转移性乳腺癌的治疗。除二线治疗HR+乳腺癌外,SHR6390还开发用于晚期一线相关治疗,目前正在一项Ⅲ期临床中评估SHR6390联合芳香化酶抑制剂对比芳香化酶抑制剂治疗HR+、HER2-晚期乳腺癌的潜力。
2.爱思迈生物CD20/CD3双抗申报临床。爱思迈生物1类新药EX103注射液的临床试验申请获NMPA受理。EX103是爱思迈生物自主开发的一款CD20/CD3双抗,能同时结合CD20/CD3阳性的肿瘤细胞和T细胞,激活并引导T细胞杀伤肿瘤细胞,提高抗体药物的治疗效果,拟用于治疗非霍奇金淋巴瘤(NHL),慢性B淋巴细胞白血病(CLL)和类风湿性关节炎(RA)等。此前,国内已有罗氏的glofitamab和mosunetuzumab,以及再鼎的REGN1979等3款同靶点产品申报临床。
3.强生2款新药申报临床。国家药监局受理强生2款新药的临床试验申请,分别为PD-1单抗Cetrelimab和吉西他滨改良型新药TAR-200。Cetrelimab拟用于治疗尿路上皮癌、黑素瘤、胃癌、食管癌等恶性肿瘤,在国外处于III期开发阶段。TAR-200由TARIS公司(已被强生收购)药物递送技术开发的可在膀胱内持续数周连续释放化疗药物吉西他滨。在美国,FDA已授予TAR-200快速通道资格,用于治疗不适合根治性疗法的肌肉浸润性膀胱癌(MIBC)患者。
4.奥赛康ALK5抑制剂新药申报临床。奥赛康1类新药ASKC852片的临床试验申请获CDE受理。ASKC852是国内继劲方药业、礼来、圣和药业、璎黎药业后第5家申报临床的ALK5抑制剂。其中,礼来ALK5抑制剂galunisertib目前进展最快,国际已处于II/III期临床阶段,在针对肝细胞癌、胰腺癌、骨髓增生异常综合征等适应证的II期临床均产生积极结果。此外,辉瑞、阿斯利康、葛兰素史克、BMS等国际药企也布局该靶点药物。
5.华东医药收购道尔生物75%股权。华东医药旗下杭州中美华东以4.875亿元人民币收购转让方持有的道尔生物75%股权,成为道尔生物第一大股东。道尔生物是一家创新生物大分子抗体研发企业,拥有6款临床前期候选药物,肿瘤领域:DR30318(Claudin18.2/CD3),DR30206(PD-LI/TGFB/VEGF)和DR30303(Claudin 18.2)。代谢领域:DR10624(GLP-1R/GCGR/FGFR1c-β Klotho三特异激动剂)、DR10627(GLP-1R/GIPR双特异激动剂,速效日制剂)和 DR10628(GLP-1R/GIPR 双特异激动剂,长效周制剂)。此次交易,加强了华东医药在抗体药物的研发能力。
6.北海康成布局罕见病基因编辑疗法。北海康成与LogicBio Therapeutics达成战略合作协议。LB-001是LogicBio公司开发的拟用于治疗甲基丙二酸血症(MMA)的基因编辑疗法。根据协议,北海康成将获得LB-001在大中华区开发和商业化的独家授权和另外两个未公开的基因治疗项目的选择权,以及生产AAV sL65基因疗法(拟用于治疗法布里病和庞贝病等)的全球许可。LogicBio将获得1000万美元的预付款、期权付款、最高达5.81亿美元的临床、监管和商业里程碑付款以及净销售额高达两位数的特许权使用费。
国际药讯
1.FDA专家组支持Tecentriq保留TNBC标签。FDA咨询委员会专家组以7:2投票支持保留罗氏旗下基因泰克PD-L1抗体Tecentriq用于晚期三阴性乳腺癌(TNBC)的治疗。基于Ⅲ期临床IMpassion130试验的积极结果,2019年3月,FDA加速批准Tecentriq联合Abraxane(白蛋白紫杉醇)一线治疗PD-L1阳性的不可手术切除的局部晚期或转移性TNBC。但在验证性Ⅲ期临床IMpassion131中,与紫杉醇相比,Tecentriq与紫杉醇联用未能改善患者的无进展生存期(PFS)和总生存期(OS)。
2.Aldeyra新机制眼药水到达Ⅲ期临床终点。Aldeyra公司新型免疫调节共价RASP抑制剂reproxalap滴眼液在治疗过敏性结膜炎的Ⅲ期临床INVIGORATE中达到主要终点和所有次要终点。接受reproxalap治疗的患者,在接受过敏原挑战后110-210分钟内,眼痒程度与对照组相比显著降低(p<0.0001);过敏导致的眼红和流泪程度也显著降低;试验中未观察到安全性或耐受性问题。预计今年下半年即将向FDA提交新药上市申请。
3.武田EGFR抑制剂获FDA优先审评。FDA授予武田EGFR/HER2抑制剂mobocertinib(TAK-788)的新药申请优先审评资格,用于治疗EGFR外显子20插入阳性的转移性非小细胞肺癌。在一项Ⅰ/Ⅱ期临床中,mobocertinib在这类转移性患者中达到28%的确认客观缓解率,中位缓解持续时间为17.5个月,疾病控制率达到78%。此前,该新药已获FDA授予的突破性疗法认定。在中国, mobocertinib已于去年10月获CDE纳入突破性治疗品种。
4.默克IL-17A/F三特异性抗体Sonelokimab II期结果优异。Ablynx/默克IL-17A/F三特异性纳米抗体Sonelokimab(M1095)治疗斑块状银屑病的Ⅱ期临床(NCT03384745)达到所有主要和次要终点指标。M1095所有剂量组第12周时达到主要终点,与基线相比均具有显著的临床和统计学意义(p<0.001);银屑病面积和严重程度指数(PASI 75,PASI 90和PASI 100)对比基线也具有显著的统计学意义(p≤0.002);M1095总体耐受,安全性与银屑病的其他生物疗法相一致。
5.基因疗法VY-HTT01计划重启亨廷顿病临床。FDA日前解除了Voyager Therapeutics公司一款亨廷顿病(HD)基因疗法VY-HTT01的临床暂停。VY-HTT01临床试验项目此前被叫停,主要是基于化学、制造和控制(CMC)方面的问题。Voyager公司计划今年重启Ⅰ/Ⅱ期临床试验VYTAL,继续评估VY-HTT01用于早期HD患者的治疗潜力。HD的主要病因是huntingtin基因发生突变,产生了有毒性的突变亨廷顿蛋白。目前,针对HD,尚无疾病修正疗法。
医药热点
1.美疾控中心:已接种疫苗者在户外无需戴口罩。美国疾控中心27日更新了新冠疫情防控指南,放宽户外戴口罩的要求,特别是已经完全接种疫苗的人们在大多数户外情况下无需戴口罩。新指南指出,已经完全接种疫苗的人们,在户外参加小型聚会、运动、出行的时候,无需佩戴口罩。但在参加人群聚集的活动时,已经完全接种疫苗的人们仍需佩戴口罩,例如看演出或参加体育赛事的时候。
2.九部委联合发布纠风工作要点。国家卫健委、工信部、公安部等9个部门日前发布《关于印发2021年纠正医药购销领域和医疗服务中不正之风工作要点的通知》。《通知》明确,今年的纠风工作要点包括5个方面,除治理行业乱象、严查欺诈骗保外,要坚决做好新冠肺炎疫情防控领域纠风工作,还包括打击以快速核酸检测为名实施的诈骗或故意篡改核酸检测证明违法违规行为等。
3.在印度传播的变异病毒已在17国出现。当地时间4月27日,世卫组织透露,全球流感数据共享平台GISAID收到的超过1200个序列显示,至少已有17个国家发现了感染印度新冠变异毒株B.1.617的病例。大部分序列上传于印度、英国、美国和新加坡。世卫组织近日将B.1.617变异病毒列为“待观察变种”,目前仍未将该变种列为“须关注变种”。
审评动向
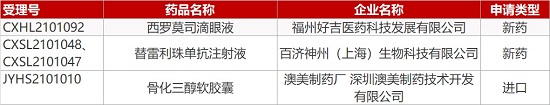
1. CDE新药受理情况(04月28日)
申请临床:
福州好吉医药的西罗莫司滴眼液、百济神州的替雷利珠单抗注射液(2个规格)。
申请生产:
澳美制药厂/深圳澳美的骨化三醇软胶囊。
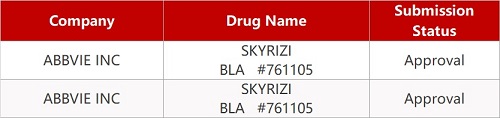
2. FDA新药获批情况(北美04月26日)
股市资讯
【恒瑞医药】(1)碘克沙醇注射液(100ml:32g(I))通过一致性评价(2)子公司注射用SHR-A1904临床试验获批。
【复星医药】复宏汉霖的斯鲁利单抗注射液(PD1-单抗)纳入优先审评审批程序。
【复宏汉霖】斯鲁利单抗注射液(PD1-单抗)纳入优先审评审批程序。

来源:药研发


