您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-04-06 15:13
「 本文共:18条资讯,阅读时长约:3分钟 」
今日头条
中国新冠疫苗获欧盟GMP认证。4月1日,国药中生北京公司新冠灭活疫苗(Vero)获匈牙利国家药审监管机构正式颁发欧盟GMP证书,成为中国历史上首个在欧盟获批使用和GMP认证的疫苗产品,迈出了中国新冠疫苗成为全球公共产品新的一步。国药中生旗下新冠疫苗目前除了在国内获批附条件上市外,还在阿联酋、巴林、玻利维亚、塞舌尔获批注册上市。全球范围内,该集团的新冠疫苗全球供应和接种已双双突破1亿剂。
国内药讯
1.豪森来那度胺胶囊获批上市。豪森药业生物类似药 “来那度胺胶囊”获国家药监局批准上市。来那度胺是新基医药开发的新一代口服免疫调节药物,是多发性骨髓瘤(MM)的一线用药,临床广泛应用于多发性骨髓瘤、淋巴瘤、骨髓增生异常综合症、急性髓系白血病等疾病的治疗。原研产品瑞复美(Revlimid,来那度胺)已于2013年获批进入中国。
2.济民可信新冠中和抗体获FDA临床批准。济民可信集团自主研发的新冠病毒中和抗体注射液(项目代号:JMB2002)日前获得FDA的临床许可。据悉,JMB2002能够精准占据病毒S蛋白的S1亚基上受体结合域(RBD)与ACE2结合界面的关键表位,对包括在南非发现的变异株(B.1.351)在内的不同突变病毒刺突糖蛋白均显示出良好的结合和阻断活性。今年1月,JMB2002已在中国启动Ⅰ期临床。
3.华东医药First-in-class ADC新药获批临床。华东医药子公司中美华东制药1类进口生物药IMGN853(Mirvetuximab Soravtansine)获CDE临床许可,适应症为叶酸受体α高表达的铂类耐药的晚期高级别上皮性卵巢癌、原发性腹膜癌或输卵管癌患者。IMGN853是中美华东合作伙伴ImmunoGen公司研发的一款FRα靶向抗体-药物偶联物(ADC),已在美国治疗FRα高表达卵巢癌的III期临床(IMGN853-0403)中获得积极结果。ImmunoGen预计今年下半年向FDA递交IMGN853的上市申请。
4.亘喜CAR-T疗法Ⅰ/Ⅱ期临床首例患者入组。亘喜生物供者来源异基因、CD19靶向CAR-T疗法GC007g的Ⅰ/Ⅱ期注册性临床研究完成首例患者入组。这项研究旨在评估GC007g治疗复发/难治性急性B细胞淋巴细胞白血病患者的安全性及有效性,重庆新桥医院(陆军军医大学第二附属医院)血液病医学中心张曦教授担任主要研究者。
5.强生BCMA/CD3双抗在华申报临床。强生BCMA/CD3双抗Teclistamab注射液临床试验申请(受理号:JXSL2101002/3)获CDE受理。Teclistamab旨在使具有肿瘤杀伤作用的T细胞聚集于表达BCMA的多发性骨髓瘤(MM)细胞周围,从而使T细胞能够被激活并诱导杀死BCMA阳性癌细胞。在一项用于治疗多发性MM的I期临床(NCT03145181)中,teclistamab (RP2D,1500µg/kg)总缓解率(ORR) 达到73%(16/22),部分缓解率(PR)为55%(12/22),完全缓解率(CR)为23% (5/22)。
6.勤浩医药创新KRAS抑制剂GH35申报临床。勤浩医药1类新药GH35的临床试验申请获CDE受理。GH35是一款KRAS G12C抑制剂,已在临床前实验中显示出有高选择性、良好的代谢及安全性等特点。此次也是勤浩医药在中国递交的首个临床试验申请。据悉,KRAS基因突变存在于多种肿瘤中,其中G12C突变主要存在于肺癌、结直肠癌和胰腺癌。
国际药讯
1.辉瑞新冠疫苗南非试验数据防护力100%。辉瑞/BioNTech新冠疫苗BNT162b2在Ⅲ期临床中获最新结果。截至2021年3月13日的研究数据显示,BNT162b2防护COVID-19的效力达到91.3%(95% CI: 89.0,93.2),而且防护效力至少持续6个月。在新冠突变病毒株B.1.351流行的南非进行的临床试验数据显示(n=800),这一疫苗的防护效力达到100%(95% CI, 53.5,100.0)。试验结果与针对新冠突变病毒株进行的体外中和抗体实验结果一致。
2.赛诺菲/再生元PCSK9单抗新适应症获FDA批准。FDA批准赛诺菲和再生元联合开发的抗体药物Praluent(alirocumab,阿利西尤单抗)用于纯合子型家族性高胆固醇血症(HoFH)成人患者的新适应症上市申请(sBLA)。在一项临床试验中,alirocumab与安慰剂相比显著降低了患者 LDL-C 水平(27%vs9%)。Alirocumab是美国首个获批的 PCSK9抑制剂,已于2015年7月被FDA批准用于杂合子家族性高胆固醇血症和动脉粥样硬化心血管疾病事件的预防。
3.吉利德CAR-T疗法向FDA递交sBLA申请。吉利德(GLD)公司旗下Kite公司CAR-T细胞疗法Tecartus(brexucabtagene autoleucel) 在美国提交了补充上市申请(sBLA),用于治疗复发或难治性B细胞前体急性淋巴细胞白血病(ALL)。基于患者总体缓解率和缓解持续时间数据, Tecartus已于2020年7月获FDA加速批准上市,成为首个也是唯一一个获FDA批准用于复发或难治性套细胞淋巴瘤的CAR -T细胞疗法。据悉,Tecartus上市5个月,便获得了0.44亿美元的收入。
4.创新FGFR抑制剂获FDA突破性疗法认定。FDA授予日本大鹏旗下Taiho Oncology不可逆FGFR口服抑制剂futibatinib(TAS-120)突破性疗法认定,用于治疗经治、FGFR2基因重排或融合的局部晚期或转移性胆管癌患者。一项公布于去年ESMO Asia会议上的Ⅱ期临床FOENIX-CCA2数据显示,在67例随访时间超过6个月的患者中,futibatinib达到37.3%的客观缓解率,82.1%的疾病控制率,中位缓解持续时间达到8.3个月,中位无进展生存期达到7.2个月。
5.住友制药拟在美开展干细胞治疗帕金森研究。住友制药干细胞疗法在帕金森病动物模型的试验中获积极结果。该公司研究团队使用iPS细胞来分化为健康的神经细胞,并将这种健康的神经细胞移植到帕金森病动物模型的大脑中。结果表明这种治疗可改善运动功能,具有很高的临床应用前景。住友制药计划2022年在美国开展使用iPS细胞治疗帕金森病患者的临床试验。
6.渤健阿尔茨海默单抗aducanumab遭FDA委员会反对。FDA外周和中枢神经系统药物咨询委员会的三名成员在JAMA杂志上发表了他们对渤健阿尔茨海默病治疗药物aducanumab(Aβ单抗)的反对意见。他们认为随机试验仍然是监管者用来评估产品疗效的主要手段。然而,该单抗在剂量研究302(EMERGE)和独立观察研究301(ENGAGE)中,只有一个有阳性结果,缺乏有说服力的证据支持aducanumab的批准。
7.葛兰素史克出售2种抗癌药特许权使用权。葛兰素史克宣布将其Exelixis药物Cabometyx和Cometriq的专利权出售给Royalty Pharma,并获得了3.42亿美元的预付款以及可能达5,000万美元的里程碑付款。葛兰素史克希望筹集超过22亿美元的现金来为拆分消费保健部门提供资金。Royalty Pharma将获得cabozantinib在美国以外地区的净销售特许权使用费,以及截至2026年9月的美国特许权使用费销售。
医药热点
1.慢病长处方新规即将出台。国家卫健委发布《长期处方管理规范(试行 征求意见稿)》。意见稿明确,长期处方是指具备条件的医师按照规定,对符合条件的慢性病患者开具的处方用量适当增加的处方。长期处方的处方量一般在4周内,有条件的地区可根据慢性病特点适当延长,最长不超过12周。地方卫健行政部门应当根据实际情况,制定长期处方适用疾病病种及长期处方用药药品目录。
2.北京协和科研门诊开诊。据北京协和医院微信公众号消息,由22位北京协和方法学专家组成的科研门诊日前持续开诊。该门诊针对北京协和医院院内职工开放,主要针对课题研究,科研设计问题及写作等提供咨询意见。据悉,“十二五”期间,北京协和医院SCI文章发表量年均增长率达27%,每篇论文影响因子平均增长0.5,其中IF 5分以上的SCI文章保持年均50%的增速。北京协和医院已连续11年蝉联《中国医院排行榜》榜首。
3.世界首个带新冠病毒抗体的婴儿诞生。根据西班牙当地时间4月1日报道,世界上首个带有新冠病毒抗体的婴儿在西班牙出生。这位名叫布鲁诺的婴儿出生于伊比萨岛,他的母亲在怀孕的第三个月接种了新冠疫苗。血液检查结果显示,母亲和婴儿血液中都有新冠病毒抗体,婴儿体内的抗体值比母亲略低。
4.云南新增确诊新冠病例15例。4月4日0时至24时,云南新增确诊病例15例,新增无症状感染者5例。新增确诊病例和无症状感染者均为瑞丽市在全员核酸检测中发现。据瑞丽市3日通报的消息,引起瑞丽疫情的病毒高度疑似是通过人或物从缅甸输入。目前康希诺15万剂单针新冠疫苗已陆续抵达云南,将助力德宏州包括瑞丽在内的广大边境地区民众尽快完成疫苗接种。预计4月6日前全市适宜人群将全部接种完毕。
审评动向
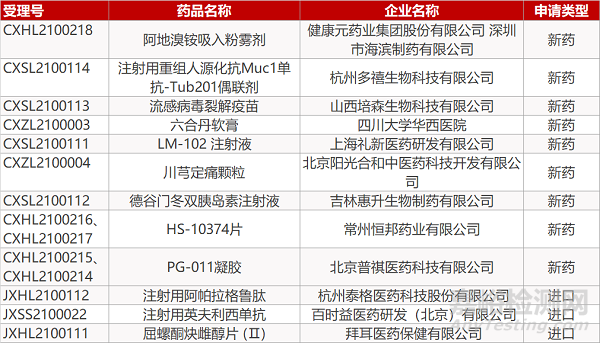
1. CDE新药受理情况(04月05日)
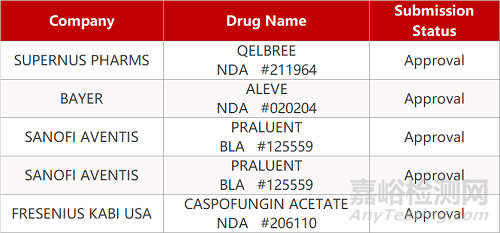
2. FDA新药获批情况(北美04月02日)

来源:药研发


