您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-15 09:08
1. 溶解:是指一种或一种以上物质(溶质)以分子或离子状态分散在另一种物质(溶剂)中形成均匀分散体系的过程;
2. 溶液:是指由溶解过程所形成的分散体系;
3. 相互作用力:范德华力、氢键力和偶极力;一般来说,偶极力>氢键力>范德华力;
4. 溶解度(solubility):指在一定温度(气体在一定压力)下,在一定量溶剂中达到饱和时溶解药物的最大量;
5. 特性溶解度(intrinsic solubility):是指不含任何杂质的化合物,在溶剂中不发生解离、缔合,不与溶剂中的其他物质发生相互作用时所形成的饱和溶液的浓度;
6. 平衡溶解度(equilibrium solubility):是指在测定药物溶解度时不排除溶剂、其他成分影响,此时测得的溶解度称为平衡溶解度或表观溶解度;
7. 溶出度(dissolution):系指在规定的溶剂中,药物从片剂、胶囊等固体制剂中溶出的速度和程度。
详细介绍
一.溶解度的测定
1.《中国药典》2015版规定
称取(或量取)供试品置于25℃一定容量溶剂中,每隔5min强力振摇30s,观察30min内的溶解情况,若看不到溶质颗粒或液滴,视为完全溶解。以此判断药物的溶解度
2. 特性溶解度的测定
❖ 依据相容原理图确定
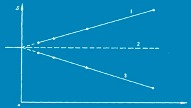
❖ 以药物浓度为纵坐标,以药物质量/溶剂体积的比值为横坐标,直线外推值比例为零,此时得到的即为特性溶解度;
3.平衡溶解度的测定
❖ 可查询相关资料或法规得到,或用法规规定方法进行测定;
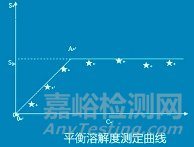
4.平衡溶解度的测定
❖ 温度:兼顾贮存和使用情况(4~5℃,25℃,37℃);
❖ pH值:往往需要测定不同pH值时的溶解度,为溶出介质的选择提供参考;
❖ 恒温搅拌和达到平衡的时间
二.影响溶解度的因素
1. 药物极性
❖ 药物的溶解度是药物与溶剂相互作用的结果;
❖ 若药物与溶剂形成分子间氢键,在极性溶剂中溶解度大,但在非极性溶剂中溶解度小;
❖ 若药物与溶剂形成分子内氢键,在极性溶剂中溶解度小,但在非极性溶剂中溶解度增大;
❖ (针对药物结构)形成可溶性盐或在分子中引入亲水基团——增加水中溶解度;
2. pH值和同离子效应
❖ 大多数药物为弱酸或弱碱,其溶解度与pH有关;pH值不仅能影响药物的溶解度,还对药物的有效性、安全性和稳定性有影响,所以在进行pH调节时应综合考虑各方面的因素;
❖ 由于胃肠道较为复杂的pH梯度变化,因此,在胃肠道生理pH范围的溶解度差的药物,往往生物利用度低;
❖ 此外,一般在难溶性盐类饱和溶液中,加入相同离子化合物时,会降低其溶解度;例如:有些盐酸盐类药物+生理盐水(0.9%氯化钠)配伍时,溶解度会降低;
3. 温度
❖ 取决于溶解过程是吸热过程还是放热过程;
❖ 若为吸热过程,则溶解度随温度升高而增大;
❖ 若为放热过程则相反,升高温度,溶解度反而减小;
❖ 若溶解过程既不吸热也不放热,则溶解度不受温度的影响;如氯化钠的溶解;
4. 溶剂化作用和水合作用
❖ 药物离子的水合作用与离子性质有关;通常情况下,阳离子与水之间的相互作用力更强;
❖ 离子大小和离子表面积是水分子极化的决定因素;
5. 药物的晶型——多晶型(polymorphism)
❖ 多晶型:是同一物质具有两种或两种以上的空间排列和晶胞参数,形成多种晶型的现象;
❖ 不同晶型具有不同的理化特性,对药物的溶解度和体内生物学行为影响很大;
通常,稳定型:熔点高、溶解度小;
亚稳定型或无定形:熔点低、溶解度大;
❖ 此外,多晶型药物还应特别注意晶型转化问题;
❖ 近年研究显示,药物共晶可以显著增加药物溶解度,如卡马西平共晶,其溶解度提高近百倍;
6. 粒子大小
❖ 对于水溶性药物和粒径大于2μm的难溶性药物,粒径大小对药物溶解度的影响不大;
❖ 对于难溶性药物,粒径小于100nm时,药物的溶解度与粒径大小有关;并且随着粒径的减小,溶解度增大;
❖ 目前常用的微粉化技术如气流粉碎,仅能达到微米级别,故对药物溶解度的影响不大;
7. 粒子的其他性质
三.增加溶解度的方法
1. 增溶(solubilization)
❖ 增溶剂:具有增溶作用的表面活性剂;(胶束增溶)
❖ 影响增溶的因素:
增溶剂种类:如极性药物,非离子表面活性剂的HLB值越大,增溶效果越好;HLB 15~18;
药物的性质:一般,药物分子量越大,增溶量越少;
加入顺序:一般药物先与增溶剂混合后再加入溶剂;
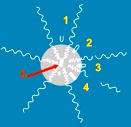
1→亲水性药物;2~4→两亲性药物;5→疏水性药物
2. 助溶(hydrotropy)
❖ 助溶剂:难溶性药物与加入的第3种物质在溶剂中形成可溶性分子间配伍物、复盐或缔合物等以达到增加溶解度的目的,第3种物质即为助溶剂;
❖ 助溶剂的分类:
有机酸及其钠盐:如苯甲酸钠、水杨酸等——咖啡因、核黄素等;
酰胺化合物:乌拉坦、尿素、烟酰胺等——盐酸奎宁等;
无机盐:如碘化钾——碘。
3. 潜溶(cosolvency)
❖ 潜溶剂(cosolvent):显著增加药物溶解度的复合溶剂;
❖ 如水+极性溶剂(如乙醇、丙二醇、甘油、PEG等)(乙醇,肌注:浓度宜尽量低,减小刺激;丙二醇,口服:有辛辣不适感);
❖ 注意:潜溶并不是所有的比例都能显著的增加药物的溶解度,这种混合溶剂需要在特定的比例,特定的范围之内才能达到最佳的增溶效果;
❖ 影响因素:
混合溶剂中各溶剂的不利:最佳比例需实验确定,应注意混合及滴注过程中可能由于溶剂比例的变化,而导致溶解度变化,产生沉淀或其他不良反应;同时,滴注速度宜缓慢;
混合溶剂种类:水性注射剂,多选丙二醇、甘油、PEG,如苯巴比妥:35%苯二醇或乙醇,如尼莫地平注射液,50%乙醇。
4.制成盐类
❖ 如难溶性弱酸、弱碱——成盐
❖ 弱酸类:如苯巴比妥类、磺胺类——氢氧化钠、碳酸氢钠等碱成盐;
❖ 弱碱类:普鲁卡因、可卡因等——盐酸、磷酸、枸橼酸等酸成盐;
❖ 注意问题:除了影响溶解度,还可能引起稳定性、刺激性等方面的变化;如乙酰水杨酸钙要比乙酰水杨酸钠更稳定;奎尼丁盐酸盐刺激性小于奎尼丁葡萄糖酸盐;
5.药物共晶
❖ 药物共晶:药物活性分子与共晶试剂通过分子间作用力(如氢键)形成的新晶型。——不破坏药物共价结构;
❖ 例如:
卡马西平——烟酰胺:化学稳定性提高;
呋塞米——腺嘌呤:10%乙醇溶液中的溶解度提高6~11倍;
美洛昔康——阿司匹林:溶解度提高40几倍;
6. 其他方法
❖ 微粉化技术:促进溶出,但对药物溶解度影响不大;
❖ 包合技术:改善水溶性;
❖ 固体分散技术:提高分散度,增加溶解度;
7. 补充
❖ 值得注意的是,在增加药物溶解度的同事,要兼顾考虑药物的稳定性、疗效和安全性。
四.溶出速度
1. 溶出度(dissolution)
❖ 系指在规定的溶剂中,药物从片剂、胶囊等固体制剂中溶出的速度和程度;
2. 溶出过程
❖ 溶质分子从固体表面溶解,形成饱和层;
❖ 经过扩散层,进入溶液内。
3.Noyes-Whitney方程
❖ dC/dt=kS(Cs-C);
式中,k:溶出速率常数;S:药物颗粒表面积;Cs:药物溶解度;
当Cs≫C时,公式简化为:dC/dt=kSCs;
漏槽条件(sink condition):即药物溶出后立即移除,或溶出介质的量很大,溶液中的药物浓度很低;
五.影响药物溶出速度的因素
1. 固体的粒径与表面积
崩解、粒径
2. 药物的溶出速率常数
搅拌、温度、黏度
❖ 扩散系数——受介质黏度和药物分子大小的影响;
❖ 扩散层厚度——搅拌;
3. 药物的溶解度
温度、晶型、制剂工艺
4. 剂型因素
处方、工艺

来源:艾特森制药装备


