您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-01-08 15:11
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.绿叶制药注射用利培酮缓释微球即将获批。绿叶制药注射用利培酮缓释微球上市申请处于“在审批”阶段,有望近期获批上市,成为国产首家上市的该产品注射用缓释微球剂型。注射用利培酮缓释微球用于治疗急性和慢性精神分裂症以及其它各种精神病性状态的明显的阳性和阴性症状,以及减轻与精神分裂症有关的情感症状(如抑郁、负罪感、焦虑)。原研产品商品名为恒德(西安杨森),于2006年1月首次获批进口中国。
2.罗氏贝伐珠单抗新适应症申报中国上市。罗氏(Roche)贝伐珠单抗(安维汀,Avastin)新适应症上市申请获CDE受理,推测新适应症可能为HER2阴性转移性乳腺癌。贝伐珠单抗是一款VEGF抑制剂,已先后在中国获批联合化疗用于转移性结直肠癌,不可切除的晚期、转移性或复发性非鳞状细胞非小细胞肺癌(NSCLC),复发性胶质母细胞瘤(GBM),以及联合PD-L1抗体阿替利珠单抗用于治疗既往未接受过系统治疗的不可切除肝细胞癌(HCC)患者。
3.云顶新耀TROP-2靶向ADC药物Ⅲ期临床获批。云顶新耀TROP-2靶向抗体药物偶联物(ADC)sacituzumab govitecan-hziy获国家药监局一项临床试验默示许可,拟开发用于治疗晚期尿路上皮癌(mUC)。这是一项国际Ⅲ期TROPiCS-04研究,旨在对经铂类药物化疗和PD-1/PD-L1抗体治疗后仍发生疾病进展的转移性或者局部晚期不可切除的尿路上皮癌患者中评估sacituzumab govitecan-hziy与标准化疗相比的治疗效果。在美国,该新药上述适应症已获FDA快速通道资格认定。
4.开拓药业普克鲁胺治疗新冠男性受试者结果积极。开拓药业在巴西开展的AR拮抗剂普克鲁胺(GT0918)治疗新冠男性受试者研究获积极结果。与安慰剂相比,普克鲁胺可显著抑制新冠患者自轻症至重症的转化,两组需要住院治疗的患者比例分别为0%和27%;且短期用药(15天)安全性良好。据悉,普克鲁胺治疗新冠女性受试者的临床试验正在巴西开展,初步数据预计近期发布。
5.东阳光PI3Kδ抑制剂启动临床。东阳光1类新药HEC89736PTSA·0.5 H2O首次在国内启动I期临床。该药是一款PI3Kδ抑制剂,拟开发用于治疗复发难治B细胞血液肿瘤。国内目前尚未有同靶点抑制剂获批,不过已有8个项目处于临床开发中。进展最快的是拜耳的库潘尼西,已在国内启动III期临床。此外有5个II期临床项目和2个I期临床项目。涉及企业包括正大天晴、信达生物、石药集团、南京圣和等。
6.维昇药业TransCon C-型利钠肽中国获批临床。维昇药业注射用TransCon CNP(TransCon C-型利钠肽)获国家药监局两项临床试验默示许可,即将在中国开展用于软骨发育不全(ACH)患者的国际II期临床ACcomplisH。TransCon CNP通过持续提供活性CNP以抑制过度激活的成纤维细胞生长因子受体3(FGFR3)信号通路,每周一次给药缓慢释放,旨在帮助ACH儿童患者重建骨骼生长平衡,同时改善和预防ACH的并发症。TransCon CNP在美国和欧盟已获孤儿药资格认定。
7.拓臻生物完成C轮融资。拓臻生物宣布完成8700万美元C轮融资,所得款项将用于推进其非酒精性脂肪性肝炎(NASH)管线(TERN-101、TERN-201和TERN-501)的临床试验。TERN-101是一款处于Ⅱa期临床开发的FXR激动剂,其主要数据预计在2021年下半年获得;TERN-201是一款VAP-1抑制剂,预计2021年上半年启动Ⅰb期临床;TERN-501是一款THR-β激动剂,将于2021年上半年开展Ⅰ期临床。该轮融资由Deerfield Management Company领投,礼来公司进行战略股权投资。
国际药讯
1.2020年创新药获批最大赢家:诺华。2020年,FDA共批准了53款新药,欧洲EMA共批准了42款新药,中国NMPA共批准了48款新药。3个主要监管机构的新药批准汇总结果显示,2020年,有20家企业收获2项以上的创新药批准。其中,诺华是最大赢家,共收获了9项批准;其次是罗氏、赛诺菲,均有6项新药批准;武田、BMS、默沙东各有4项新药批准;拜耳、吉利德、礼来和Blueprint Medicines等各有3项新药批准。
2.阿斯利康达格列净获FDA优先审评资格。阿斯利康SGLT2抑制剂达格列净(dapagliflozin)获FDA授予优先审评资格,用于治疗伴或不伴2型糖尿病(T2D)的新发或恶化慢性肾病(CKD)成人患者。在一项Ⅲ期临床DAPA-CKD中,与安慰剂相比,达格列净在标准治疗基础上,可使慢性肾病2-4期患者的复合终点风险(包含肾功能恶化或心血管或肾性死亡风险)降低39%(p<0.0001);使全因死亡风险显著降低31%(p=0.0035)。
3.罗氏联手Ribometrix开发RNA靶向小分子疗法。Ribometrix公司将与罗氏旗下基因泰克(Genentech)针对多个靶点发现和开发新型RNA靶向药物。根据协议,Ribometrix将应用其专有的发现平台,发现和优化小分子化合物;两家公司将在药物发现和临床前开发合作,基因泰克将负责进一步的开发和商业化,并获得多个预定靶标化合物的研发和商业化的全球独家许可。Ribometrix将获得2500万美元的前期付款,可能超过10亿美元的里程碑付款以及合作产品的销售分成。
4.辉瑞与Dewpoint拟开发强直性肌营养不良症潜在疗法。Dewpoint公司与辉瑞将利用Dewpoint的生物分子凝聚物开发技术,联合开发治疗强直性肌营养不良症1型(DM1)的潜在疗法。生物分子凝聚物是细胞内的一种由蛋白质和RNA组成的无膜液滴,可促进分子间的相互作用,帮助细胞发挥重要功能。冷凝物已被证明在关键的生物过程和严重的难治性疾病(包括神经退行性变、癌症等)中发挥关键作用。根据协议,Dewpoint将获得预付款,可能高达2.39亿美元的里程碑付款,以及合作产品的版税。
医药热点
1.河北邢台新冠病毒与欧洲输入病毒高度同源。1月6日晚,邢台市人民政府副市长邓素雪介绍,1月3日,第一时间将首批3例确诊患者的核酸样本,由河北省疾控中心送至国家疾控中心开展基因测序,结果显示病毒传播与欧洲输入病毒高度同源,具有流行病学联系,从而明确了本次疫情的流行病学途径。此外,邢台南宫病毒与石家庄病毒高度同源,南宫市病例与石家庄市病例有流行病学联系。
2.湖北取消所有大型聚集性活动。近日,湖北省新冠疫情防控指挥部发出通知,要求湖北各级党政机关、企事业单位一律取消集体团拜和大型慰问、联欢、聚餐等活动,确需召开举办线下大型会议活动的应严格控制人数和规模;组织或承办50人以上的会议活动,特别是有境外、省外等重点地区人员参加的,需制订防控方案并做好严格的防范措施。通知明确要求居民非必要不出门,非预约不出游。
3.第48届南丁格尔奖章中国拟推荐候选人公示。国家卫健委员发布第48届南丁格尔奖章候选人我国拟推荐人选公示,此次,共有11位护理工作者进入第48届南丁格尔奖章候选人我国拟推荐人选公示名单,其中已逝援鄂护士梁小霞入选。南丁格尔奖章是红十字国际委员会授予各国护理工作者的最高荣誉,每两年颁发一次,以表彰护理工作者的卓越成就和献身精神。
股市资讯
【恒瑞医药】(1)苹果酸法米替尼胶囊及SHR-1701注射液获批临床。(2)甲磺酸阿帕替尼片获批,新增适应症“阿帕替尼单药用于既往接受过至少一线系统性治疗后失败或不可耐受的晚期肝细胞癌患者”。
【赛隆药业】注射用艾司奥美拉唑钠获批。
【广济药业】替硝唑片通过仿制药一致性评价。
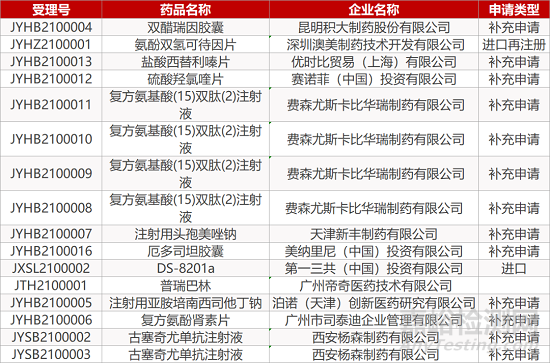
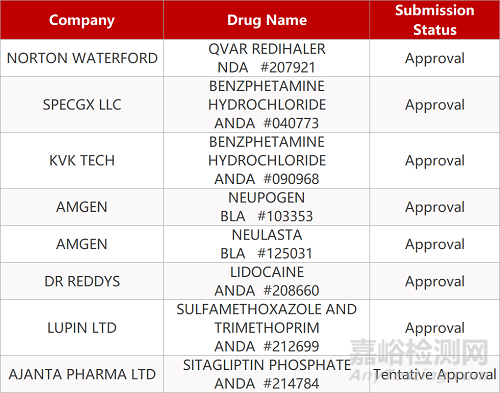
审评动向
- The End -

来源:药研发


