您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-12-04 09:16
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
国内药讯
1.恒瑞瑞马唑仑第3个适应症申报上市。恒瑞「注射用甲苯磺酸瑞马唑仑」新适应症上市申请获CDE受理,申报的新适应症预测为全身麻醉。瑞马唑仑是由GSK公司设计、Paion AG公司开发的一种短效GABAa受体激动剂,用于手术中的全身麻醉,人福医药拥有其在中国开发的权利。值得一提的是,在今年的医保谈判中,恒瑞的甲苯磺酸瑞马唑仑和人福的甲磺酸瑞马唑仑均通过了形式审查,目前正处于谈判阶段。
2.BMS在华递交Opdivo+Yervoy新适应症上市申请。百时美施贵宝(BMS)递交的免疫检查点抑制剂纳武利尤单抗(Opdivo)和伊匹木单抗(Yervoy)新适应症上市申请获CDE受理。这两款新药的联合疗法一周前刚获CDE拟纳入优先审评,拟用于治疗初治的不可切除的非上皮样型恶性胸膜间皮瘤成人患者。此次BMS同时递交这两款新药上市申请,推测可能为2款新药联合疗法。目前Opdivo+Yervoy组合在中国开展的临床适应症涉及晚期肝细胞癌、非小细胞肺癌、尿路上皮癌等。
3.贝达药业埃克替尼新适应症即将注册核查。贝达药业宣布其埃克替尼术后辅助治疗新适应症上市申请(CXHS2000030)已收到药审中心临床试验数据核查的通知,即将按注册要求开展核查。埃克替尼是贝达自主研发的我国首个拥有自主知识产权的小分子靶向抗癌药,年销售收入连续4年超10亿人民币。已获批的两项适应症为:单药一线治疗EGFR基因具有敏感突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者;单药治疗至少一个化疗方案失败后的局部晚期或转移性NSCLC患者。
4.石药“first-in-class”抗体新药在中国获批临床。石药集团附属公司AlaMab申报的1类新药ALMB-0166临床试验申请获中国国家药监局批准,即将在急性脊髓损伤中开展临床研究。ALMB-0166是一款靶向半通道膜蛋白Connexin 43的“first-in-class”人源化单抗,拟开发用于治疗急性脊髓损伤、中风、骨关节炎及其它神经系统的重大疾病。2018年,FDA已授予ALMB-0166用于治疗急性脊髓损伤的孤儿药资格。目前,ALMB-0166正在澳大利亚开展Ⅰ期临床。
5.百济神州高选择性Bcl-2抑制剂获批临床。百济神州自主研发的1类新药BGB-11417薄膜包衣片获国家药监局4项临床试验默示许可,拟用于治疗成熟B细胞恶性肿瘤。这是一款高选择性、潜在“best-in-class”的Bcl-2抑制剂,百济神州已在今年第一季度启动BGB-11417用于治疗成熟B细胞恶性肿瘤患者的Ⅰ期临床试验,并计划将其作为单药以及联合BTK抑制剂泽布替尼进行开发。
国际药讯
1.首个鼻息肉抗IgE抗体疗法获FDA批准。FDA批准诺华和基因泰克联合开发的抗体疗法Xolair(omalizumab)扩展适应症,用于作为辅助维持疗法,治疗对鼻用皮质类固醇疗法应答不足的18岁以上鼻息肉成年患者。这是FDA批准用于鼻息肉的首款IgE靶向抗体。两项Ⅲ期临床(POLYP1和POLYP2)结果均显示,与安慰剂组相比,Xolair治疗组患者在第24周时鼻息肉评分和每周平均鼻充血评分较基线的改善更为显著。POLYP1和POLYP2的结果最近发表在Journal of Allergy and Clinical Immunology上。
2.Mirum公司ASBT抑制剂在欧盟申报上市。欧洲药品管理局(EMA)受理Mirum公司ASBT抑制剂maralixibat的上市许可申请,用于治疗进行性家族性肝内胆汁淤积症2型(PFIC-2型)患者。在一项Ⅱ期INDIGO研究中,maralixibat使患者5年无移植存活率提高,包括瘙痒控制情况、肝酶和胆红素水平及生长改善情况等的其他参数均获改善。在美国,Mirum公司还启动了向FDA滚动提交maralixibat治疗Alagille综合征患者胆汁淤积性瘙痒的新药申请,预计明年第一季度完成提交,并于同年下半年上市。
3.Agios公司PKR别构激活剂获Ⅲ期积极结果。Agios Pharmaceuticals口服PKR别构激活剂mitapivat治疗丙酮酸激酶缺乏症成人患者的国际Ⅲ期临床ACTIVATE达主要终点。与安慰剂相比,mitapivat显著提高了患者血红蛋白水平,两组患者血红蛋白水平与基线相比提高1.5 g/dL以上的患者比例分别为40%和0(p<0.0001);Mitapivat还表现出良好的安全性。该公司计划明年向FDA和欧盟EMA递交监管申请。如果获批,这将是首款改变丙酮酸激酶缺乏症成人患者疾病进程的创新疗法。
4.Acceleron配体陷阱疗法ACE-1334获FDA孤儿药资格。FDA授予Acceleron公司TGF-β抑制剂ACE-1334治疗系统性硬化症(SSc)患者的孤儿药资格。ACE-1334是一款基于TGF-β超家族的配体陷阱疗法,旨在选择性靶向抑制纤维化疾病发病机制中的关键信号因子TGF-β1和TGF-β3,已在多个临床前纤维化模型中显示出较好的抗纤维化活性。此前FDA曾授予ACE-1334治疗SSc相关间质性肺病(SSc-ILD)的快速通道资格。Acceleron拟于2021年在SSc-ILD患者中启动Ⅰb/Ⅱ期临床。
5.艾伯维联手Frontier公司开发创新蛋白降解疗法。艾伯维与Frontier Medicines公司将合作发现、开发和商业化针对“不可成药”蛋白靶点的创新小分子药物管线。Frontier公司独有的化学蛋白组学(chemoproteomics)技术平台能够使用共价探针(covalent probes),发现蛋白上短暂出现的结合位点,具有靶向”不可成药“蛋白组中50%靶点的潜力。该公司同时正在开发靶向E3连接酶的新型小分子药物,根据协议,Frontier将获5500万美元的前期付款、临床前开发的部分费用以及可能超过10亿美元的里程碑付款。
6.强生收购Hemera公司眼部疾病基因疗法。强生旗下杨森制药收购了Hemera生物公司拟用于治疗黄斑变性(AMD)相关地图样萎缩的基因疗法HMR59。HMR59基因疗法是一次性的门诊眼球玻璃体内注射疗法,目前正在治疗湿性AMD患者的I期临床第二阶段中,评估HMR59治疗的长期安全性。有关该项收购,两家公司均没有披露具体的财务细节。
医药热点
1.首家儿童疾病国家区域医疗中心在河南揭牌。11月30日,首家儿童疾病国家区域医疗中心揭牌仪式在河南省儿童医院举行。为提升基层诊疗能力,国家发改委、国家卫健委等部门牵头,在患者流出多的8个省区建设区域医疗中心。首批建设10家国家区域医疗中心,涉及到儿童疾病、心血管等专业领域。河南省儿童医院与北京儿童医院合作共建3年以来,诊疗服务水平和区域辐射带动能力得到快速提升。门诊患儿外转减少3.6万人次,住院患儿减少457人次。
2.北京22家市属医院招应届生1348人。12月2日,北京市医院管理中心宣布,包括北京友谊医院、北京同仁医院、北京朝阳医院等22家市属医院将面向全国高校公开招聘2021届优秀应届毕业生1348人。各医院将根据招聘岗位的特点和要求,自行组织考试考核。应聘毕业生被正式聘用后,按照北京市和医院规定给予相应的工资福利待遇,按程序办理落户手续。
3.香港新增103例新冠确诊病例。据香港无线新闻报道,截至12月2日0时,香港新增103例新冠肺炎确诊病例,本地病例占97例,包括15例源头不明个案。香港食物及卫生局局长陈肇始2日在立法会回应议员质询时表示,特区政府初步构思让全港市民免费接种新冠疫苗,并已预留资金订购两倍香港人口的疫苗。疫苗将优先接种高风险群组约300万人,包括医护人员、长者、长期病患者等。较大规模接种预计最快将于2021年中后期进行。
股市资讯
【东方生物】公司的新型冠状病毒(2019-nCoV)IgM/IgG抗体检测试剂盒(胶体金法)产品取得《医疗器械注册证》。
【华森制药】公司的注射用阿魏酸钠获得药品补充申请批件,生产地址变更为公司第五期新建 GMP 生产基地项目生产车间。
【以岭药业】公司的连花清瘟胶囊获得乌克兰膳食补充剂注册批文。
审评动向
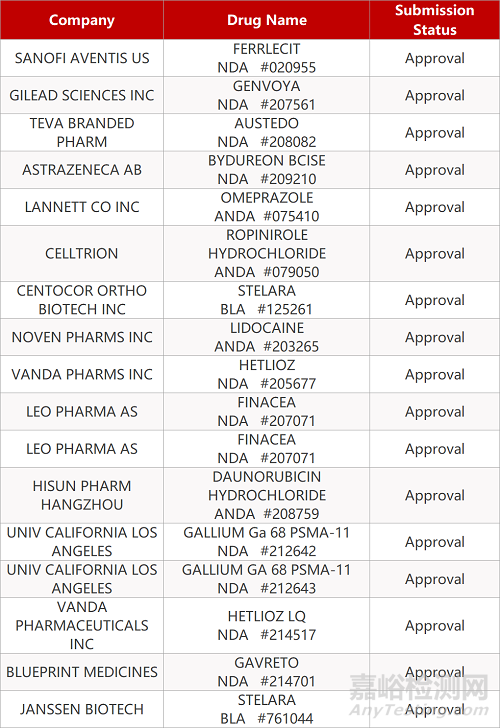
1. CDE最新受理情况(12月302日)

- The End -

来源:药研发


