您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-11-13 09:25
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「 本文共:15条资讯,阅读时长约:3分钟 」
今日头条
首款全身性给药体内CRISPR疗法进入临床试验。Intellia公司基因编辑疗法NTLA-2001在国际Ⅰ期临床中完成首例患者给药。NTLA-2001是一款基于CRISPR/Cas9技术的基因编辑疗法,具有经一次治疗可潜在治愈转甲状腺素蛋白淀粉样变性的潜力。值得一提的是,发现CRISPR基因编辑系统的Emmanuelle Charpentier教授和Jennifer Doudna教授今年斩获诺贝尔化学奖。而Intellia Therapeutics公司的联合创始人之一正是Jennifer Doudna教授。据悉NTLA-2001是首款进入临床试验的通过静脉注射,全身性给药的CRISPR基因编辑疗法。
国内药讯
1.恒瑞PD-1新适应症上市申请获受理。恒瑞医药PD-1注射用卡瑞利珠单抗又一项上市申请获CDE受理。卡瑞利珠单抗是恒瑞的重点研发产品,在中国已获批淋巴瘤、肝细胞癌、非小细胞肺癌和食管鳞癌四个适应症;其针对不同鼻咽癌适应症的两个申请也已获CDE纳入优先审评和拟优先审评名单。据悉,卡瑞利珠单抗在国内登记了15项临床试验信息,其中针对三阴性乳腺癌、胃癌、PD-L1表达阳性的非小细胞肺癌的Ⅲ期临床正在进行之中。
2.强生CD38单抗拟纳入优先审评。强生旗下杨森的CD38单抗达雷妥尤单抗注射液(皮下注射)的一项上市申请被CDE纳入拟优先审评公示名单,拟定的适应症为“治疗原发性轻链型淀粉样变患者”。值得一提的是,前不久,杨森已分别向FDA和EMA提交了达雷妥尤单抗针对这一适应症的申请。在中国,达雷妥尤单抗已于2019年7月获批用于单药治疗复发和难治性多发性骨髓瘤成年患者;其针对多发性骨髓瘤的两项新适应症上市申请刚刚获CDE纳入优先审评。
3.索元生物首个国际Ⅲ期临床新进展。索元生物“first-in-class”丝氨酸/苏氨酸激酶抑制剂DB102(enzastaurin)一线治疗初治高危弥漫性大B细胞淋巴瘤(DLBCL)的国际Ⅲ期临床ENGINE受试者全部入组。ENGINE研究是一项在中、美同步进行的随机、双盲、安慰剂对照、国际多中心Ⅲ期关键性临床试验,旨在验证DGM1阳性患者能够从DB102治疗中显著获益。值得一提的是,这是索元生物首个国际多中心Ⅲ期临床试验。
4.罗氏CD3×CD20双抗Glofitamab在华启动临床。罗氏CD20/CD3双特异性抗体Glofitamab首次在华登记启动临床,在既往两线或多线全身治疗失败后的复发/难治性弥漫大B细胞淋巴瘤(DLBCL)中国患者中评价在固定剂量奥妥珠单抗单次给药后进行Glofitamab单药治疗的药代动力学、安全性、耐受性和有效性。据悉,Glofitamab已在国外启动了7项临床试验,包括单药或联用治疗CD20阳性的B细胞非霍奇金淋巴瘤(包括弥漫性大B细胞淋巴瘤和滤泡性淋巴瘤)及其他血液癌症。最快已经进展至临床III期。
5.复星新冠mRNA疫苗BNT162b2在华申报临床。复星医药合作品种新冠疫苗BNT162b2的临床试验申请获国家药监局受理。BNT162b2是一款由 BioNTech开发的基于mRNA技术的新冠疫苗,目前正在美国、德国、阿根廷、巴西、南非和土耳其等国开展III期临床,并获得FDA快速通道审评认证。BNT162b2几天前刚刚获得有效性数据,在预防 COVID-19 方面的有效率超过 90%。复星医药拥有该疫苗在中国大陆及港澳台地区独家开发、商业化授权。
6.连花清瘟前三季度销售28.71亿元。以岭药业发布2020年第三季度报告。前三季度,以岭药业实现营业总收入64.47亿元,同比增长48.31%;实现归属于上市公司股东的净利润10.16亿元,同比增长76.74%。值得一提的是,连花清瘟产品前三季度营收28.71亿元,占营收比重为44.52%,而其去年的全年营收为17.03亿元。据悉,根据连花清瘟三季度的超前业绩,以岭药业上调全年销售预期,预计将实现40亿营收。
国际药讯
1.布地奈德靶向释放剂Nefecon达Ⅲ期主要终点。Calliditas公司布地奈德口服靶向释放剂Nefecon,在治疗原发性IgA肾病的关键性全球Ⅲ期临床NefIgArd A部分中达主要终点。在治疗9个月后,患者的尿蛋白肌酐比率(或蛋白尿)显著降低,具统计学意义;在治疗12个月后,有显著的持续性改善。该试验还达到关键的次要终点——治疗9个月后,患者肾小球滤过率估计值具统计学显著差异。Calliditas计划明年上半年分别向FDA、欧洲EMA提交其上市申请。
2.辉瑞Abrocitinib治疗重症特应性皮炎达Ⅲ期终点。辉瑞JAK1抑制剂abrocitinib治疗中重度特应性皮炎(AD)的Ⅲ期临床JADE REGIMEN结果积极。两种剂量的(200mg、100mg)abrocitinib均达到主要终点,与安慰剂组相比,治疗组在52周内没有经历急性发作的概率明显较高(分别为81.1%、57.4%和19.1%)。两种剂量同时也达关键的次要终点,即与安慰剂相比,维持研究者总体评估(IGA)反应为清除或几乎清除的患者比例更大。abrocitinib用于治疗12岁及以上中重度AD患者的新药申请已获FDA的优先审评资格,预计明年4月做出审批决定。
3.T细胞疗法联合Keytruda组合Ⅱ期临床结果积极。IMV公司新型T细胞疗法DPX-Survivac联合默沙东抗PD-1疗法Keytruda在Ⅱ期SPiReL研究中治疗PD-L1阳性复发/难治性弥漫性大B细胞淋巴瘤(r/r DLBCL)患者取得了高达86%(6/7)的客观缓解率(ORR)和100%的疾病控制率(DCR)。详细结果将在SITC2020年会上公布。DPX-Survivac基于survivin(生存素)的肽段、由IMV专有递送平台(DPX)配制组成,可针对在细胞表面存在survivin肽的癌细胞产生一种持续的细胞毒性T细胞反应。DPX-Survivac此前已获FDA授予快速通道资格和孤儿药资格。
4.FGFR2b靶向疗法Ⅱ期临床结果积极。Five Prime Therapeutics公司FGFR2b靶向单克隆抗体bemarituzumab(FPA144)与化疗联用,在一线治疗携带FGFR2b阳性、HER2阴性的晚期胃癌或胃食管连接部癌患者的Ⅱ期临床FIGHT中达主要终点。与化疗相比,Bemarituzumab+化疗将患者的死亡风险降低42%(HR=0.58, 95% CI,0.35,0.95;p=0.027);两组的中位PFS分别为9.5个月和7.4个月;bemarituzumab+化疗组OS尚未达到,化疗组OS为12.9个月。这首次表明针对FGFR2b的靶向治疗有可能降低胃癌疾病进展风险和改善总生存期。
5.mRNA癌症疫苗/Keytruda组合早期临床结果积极。Moderna公司个体化癌症疫苗mRNA-4157在早期临床中获积极结果。mRNA-4157与默沙东免疫检查点抑制剂Keytruda联用,在治疗HPV阴性的头颈部鳞状细胞癌(HNSCC)患者的Ⅰ期临床试验中,达到50%(5/10)的总缓解率(ORR)和9.8个月的中位无进展生存期(mPFS)。以前发布的Keytruda单药治疗的ORR为14.6%,mPFS为2.0个月。这一结果进一步展示了mRNA疫苗除了预防传染病以外,在治疗癌症方面的潜力。
医药热点
1.巴西新冠疫苗志愿者死因是自杀。巴西新闻网站“G1”称,在科兴中维与巴西布坦坦研究所合作研发的新冠疫苗Coronavac临床测试被叫停后,巴西卫生部和一个国际独立调查委员会均建议恢复疫苗测试。“G1”称,巴西国家卫生监督局9日紧急叫停科兴疫苗的临床测试,理由是出现“严重不良事件”。所谓“不良反应”是一名参加测试的志愿者不幸死亡。根据警方的最新通报,死者为一名32岁的圣保罗男性居民,经法医鉴定死因是自杀。
2.辉瑞新冠疫苗引发定价争议。继新冠疫苗Ⅲ期临床有效率达90%后,北京时间11月11日消息,辉瑞的合作方德国药企BioNTech表示,新冠疫苗的基准价格为每剂19.5美元。然而同日,辉瑞对媒体表示,新冠疫苗美国区定价19.5美元/剂(约合人民币128.92元/剂)是基于公司在7月与美国政府达成的协议,在该协议中,以两剂39美元的价格或每剂19.5美元的价格,向美国政府提供1亿剂潜在疫苗,并可选择在另外谈判的条件下再购买5亿剂。并且强调,此价格仅适用于美国。
3.国家医保局回复尘肺病相关医保问题。针对全国政协委员关于“将尘肺病纳入门诊特病慢病报销”的提案,国家医保局表示,基本医保在政策上不排斥任何疾病,参保人无论患有何种疾病,其就医发生的费用,符合规定的均可由医保基金支付,无法享受工伤保险待遇的尘肺病患者,可按规定享受医保待遇。目前,尘肺病治疗涉及的抗感染药、平喘药、镇咳药等药物已纳入医保范围,下一步将健全重特大疾病医疗保险和救助制度,保障尘肺病患者。
股市资讯
【复星医药】(1)控股子公司上海复星医药产业发展有限公司收到《受理通知书》,其获许可的mRNA疫苗BNT162b2用于预防新型冠状病毒肺炎获国家药品监督管理局临床试验注册审评受理。(2)控股子公司上海复宏汉霖生物技术股份有限公司、上海复宏汉霖生物制药有限公司收到《受理通知书》,其研制的重组抗CD38全人单克隆抗体注射液用于多发性骨髓瘤治疗获国家药品监督管理局临床试验注册审评受理。
【恒瑞医药】(1)子公司苏州盛迪亚生物医药有限公司的注射用卡瑞利珠单抗申报生产,拟联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗,该药品注册申请已获国家药品监督管理局受理,并被国家药品监督管理局药品审评中心纳入拟优先审评品种公示名单。(2)收到国家药品监督管理局核准签发的关于脯氨酸恒格列净片的《药物临床试验批准通知书》,并将于近期开展临床试验。
【迪瑞医疗】公司取得由吉林省药品监督管理局颁发的网织红细胞分析用质控物、体液质控物、荧光五分类血细胞分析仪用校准物和荧光五分类血细胞分析仪用质控物共4项产品《受理通知书》。
审评动向
1. CDE最新受理情况(11月12日)
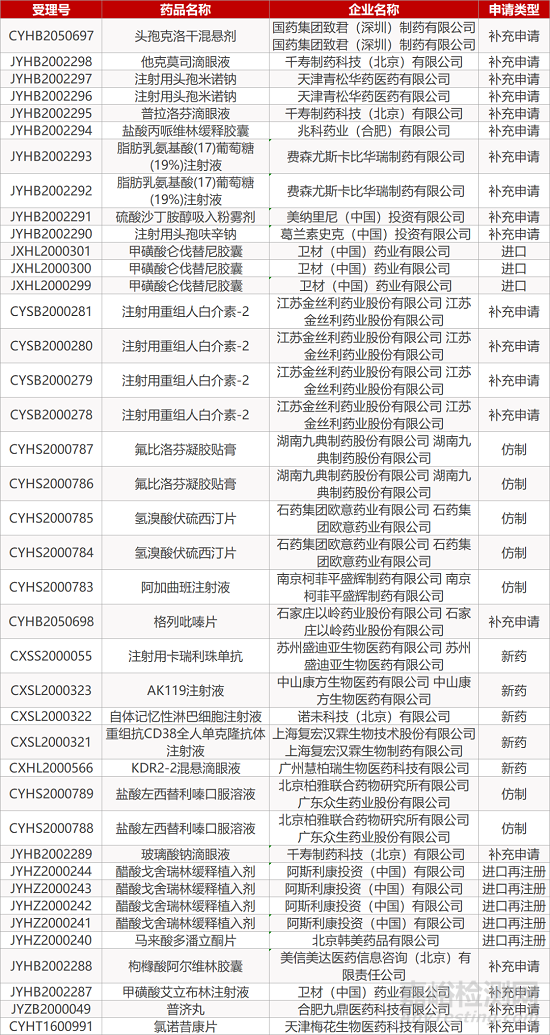
暂无
- The End -

来源:药研发


