您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2020-05-18 12:07
美国医疗器械唯一标识(UDI)系统实施进展
Progress in the Implementation of Unique Device Identification(UDI)System in the US
关键词:医疗器械唯一标识(UDI);美国食品药品管理局;UDI系统法规体系和组织架构;UDI系统项目推进情况率
医疗器械唯一标识(unique device identifier, UDI)目前已成为解决医疗器械全球监管问题的通用语言。国际医疗器械监管机构论坛(international medical device regulators forum, IMDRF)于2013年12月发布《UDI指南》[1],拉开了全球实施UDI的序幕。由于《UDI指南》只是一个框架性文件,不包括具体应用层面的指导,2017年9月,IMDRF重开UDI工作组,并于2019年3月发布《UDI应用指南》和两个信息文件《在电子健康系统中记录UDI》《UDI数据元素在不同IMDRF成员国的使用》,给各国实施UDI提供细化的指导。
我国国家药品监督管理局(NMPA)于2019年8月发布《医疗器械唯一标识系统规则》[2],自2019年10月1日起正式实施。全球范围内,美国、欧盟、沙特阿拉伯和韩国等国家和地区也已经发布UDI相关的法规和指导性文件。美国是首个在国家层面、由政府以法规形式实施医疗器械唯一标识系统(unique device Identification system, UDI system)项目的国家,当前已经实施6年。现本研究拟结合本所研究人员亲赴美国食品药品管理局(Food and Drug Administration, FDA)展开UDI调研的情况,系统概述美国UDI系统实施的法规体系和组织架构以及UDI系统项目推进情况,研讨美国UDI系统的具体实施方案,分析UDI发码机构、全球UDI数据库等美国特色的UDI系统实现方式,为我国开展和推进UDI实施工作提供借鉴和思路。
1.1 美国 FDA UDI 实施背景
1999年,美国国家医学院(Institute of Medicine)发布了研究报告《人非圣贤》,报告指出,错误地使用药物和器械导致的医疗错误是医疗事故的主要原因,而医疗错误大多是可以避免的,通过床前扫码能够有效地避免药物和器械的误用,从而极大程度地降低医疗成本。本研究报告是美国FDA积极推行药品和医疗器械条形码管理的契机[3]。2004年,FDA颁布法规,要求在药品标签上使用条形码识别,在起草时,FDA针对是否应将此项法规推广至医疗器械领域公开征求了意见,在审议过程中,FDA决定不对医疗器械应用条形码规则,并表示此类器械缺乏与国家药品代码(national drug code)系统相类似的标准和唯一识别系统,但UDI有助于减少医疗错误,便于召回,可识别器械的兼容性或过敏反应(如MRI和乳胶)、改善库存控制、完善报销方式并减少假冒产品。FDA一直在积极开展相关研究,推动UDI的实施,并委托相关咨询机构开展研究,发布了研究报告,并开展了法规实施的影响力分析,认为UDI实施利大于弊[4]。
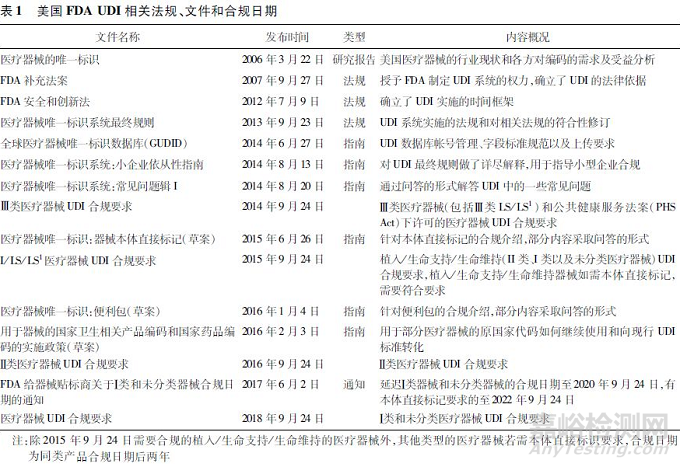
基于之前的研究成果,2007年《FDA补充法案》[5]确立了美国FDA实施UDI系统的法规依据,明确了可以发布UDI法规,要求在医疗器械的标签上赋有唯一性的标识,以便在流通和使用环节充分识别医疗器械。2012年《FDA安全和创新法案》[6]确立了UDI系统实施的时间框架,要求UDI法规草案在2012年12月31日前完成,并在征求意见结束后6个月内发布,植入器械、生命支持/生命维持类器械需要在法规发布后两年内实施UDI。2013年9月,FDA发布UDI法规,计划通过7年时间逐步实施UDI。
2013年IMDRF发布的《UDI指南》明确提出,所有UDI应用的利益相关者(从生产企业到医疗机构和患者),只有在其各工作流程系统中使用UDI,才能体现出UDI的益处。UDI规则发布后,美国同时也对联邦法规第21篇(Code of Federal Regulations Title 21, 21CFR)做了一系列适应性修订,在诸多章节中加入了UDI相关内容,例如第803部分——医疗器械报告,第810部分——医疗器械召回主管机构,第820部分——质量系统法规等,促进各方在相关环节应用UDI,从而最大程度发挥UDI的作用。FDA陆续发布了一系列指南性文件,指导企业实施UDI。指南文件包括唯一标识的关键性要求,例如数据库填报、关键性技术(如针对医疗器械本体直接标识等)以及特定类型的医疗器械产品(如针对器械包发布的指南等)。FDA并没有在法规规则的同时一次性发布所有的指南,而是在UDI实施过程中,结合产品的合规日期逐步发布。见表1。
2 美国 FDA UDI 实施情况
2.1 美国 FDA UDI 施行组织架构
美国FDA成立了专门的UDI工作团队,具体由FDA设备仪器与放射健康中心(Center for Devices and Radiological Health, CDRH)的监管和统计办公室(Office of Surveillance and Biometrics, OSBO)和FDA信息化办公室负责。美国UDI数据库的公众查询平台是由FDA与美国国立医学图书馆合作建立,可供公众免费查询、数据库下载等。
2.2 发码机构的认可情况
美国FDA UDI规则在很大程度上依赖于国际标准和全球公认的发码机构。FDA要求UDI的发码机构能够满足以下条件:①为非盈利私人机构或者国家机构;②符合ISO/IEC15459标准的2、4、6部分;③仅使用来自ISO/IEC646标准中的字符和数字;④对所有的使用者一致、公正和合理;⑤能够协调各利益相关方之间的冲突,该冲突将妨碍申请人构建一个公平和中立标识系统。
美国FDA对发码机构采取的是认可的方式,满足条件的发码机构需向FDA提供书面的申请,并按照要求提供材料和支持文件。FDA认可发码机构的期限是3年,到期后可以申请更新,FDA保留撤销认可的权力。发码机构需要保存贴标商列表并在每年12月31日前以电子文档的形式向FDA提供该列表。目前,FDA认可了国际物品编码组织(GS1)、健康行业商务通信委员会(HIBCC)和国际血库自动化委员会(ICCBBA)3家发码机构。在数据库中,根据FDA 2016年7月数据,采用GS1作为发码机构的数据约占80%,HIBCC数据约占20%,而ICCBBA数据只有1~2条记录,基本可以忽略不计。
2.3 UDI 数据库的建设情况
2013年9月20日,美国UDI数据库正式上线,当时并未开放公众在线查询功能。美国FDA于2014年6月发布UDI数据库指南,指导行业上传相关数据,指南发布的时间为在首批产品实施UDI前3个月,对首批需要合规的企业具有很好的指导作用。2015年5月4日,FDA与美国国立医学图书馆合作,发布了GUDID公众数据平台(Access GUDID),可供公众免费查询、数据库下载等。数据库运行至今,经过多次的更新,截止至2019年9月,已经由最初发布时的1.0版更新到最新的2.4.6版[7]。
3 美国 FDA UDI 实施的经验
美国FDA咨询系统(FDA helpdesk)是UDI法规实施获得成功的关键因素之一。截至2016年7月25日,UDI咨询系统总共收到超过20000个问题,超过95%的问题已经成功解答。目前,FDA平均每个月会收到1300个问题,在新的实施日期到来时,收到的提问会增加。赴FDA调研时,按照提问的总类,位于前3位的问题分别是监管政策、技术和账户相关的问题。当前,由于数据库数据量逐渐增加,FDA新设置了数据质量问题的选项。FDA会对收到的问题进行分类,并对比以往回答的问题中是否有相似的问题,从而加快问题回答的速度;对于共性问题,FDA还制定了UDI常见问题集,提高企业对UDI的理解。
积极沟通交流形成良好的实施氛围也是至关重要的。美国FDA在法规制定和实施过程中多次召开研讨会,征求企业的意见,并发布一系列指南和网络教程。此外,行业组织自发形成联盟,积极探讨UDI实施有关问题,借以加强行业之间的沟通和交流,例如医疗保健资源和材料管理协会(The Association for Health Care Resource & Materials Management, AHRMM)是医疗保健供应链专业人员的行业协会,其是美国医院协会的组成部分,开发了学习UDI社区(LUC)[8],着重讨论如何在医疗保健领域实施UDI。
① 数据维护及质量问题。医疗器械产品的上市状态和新规格型号的不断更新推出、企业的兼并重组等都会导致数据库信息发生变化,因此UDI数据库需要长期的更新和维护。与此同时,数据质量是UDI全面实施面临的主要挑战,虽然美国FDA在建立UDI数据库中尽可能采取结构化的数据,如是否和下拉选项等方式,避免使用纯文本,但企业填写中还是存在不规范的现象,数据质量有待提高。
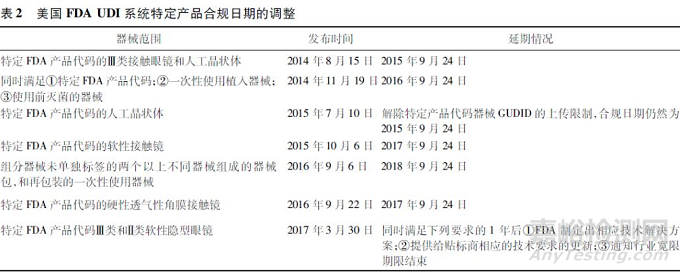
③ 部分类别医疗器械实施难度大。虽然美国FDA UDI法规明确了各类型医疗产品的合规日期,但是在实施UDI的过程中,由于医疗器械的多样性,部分类型产品难以满足法规要求,美国FDA发布了一系列的通知,推迟了特定类型产品的合规日期,对于某些特殊类别的产品,如软性接触镜,FDA反复推迟实施日期直至寻找到合适的解决方案。见表2。
4 美国 FDA 实施 UDI 对我国的启示
美国FDA UDI法规已经发布6年时间,实施过程中有很多经验可以借鉴,同时也暴露了一些问题需要重视和思考:
⑤ 实施中的共性问题有必要明确。UDI实施中很多问题具备普遍性,如在实施初期政策法规和技术问题比较多,美国FDA针对UDI系统实施中的共性问题,制定了UDI常见问题集,有效地指导了行业的合规。
参考文献:
[1] International Medical Device Regulators Forum(IMDRF) UDI Guidance[EB/OL]. (2013-12-09)[2019-09-24].
http://www.imdrf.org/docs/imdrf/final/technical/imdrf-tech-131209-udi-guidance-140901.pdf.
[2] 国家药品监督管理局. 国家药监局关于发布医疗器械唯一标识系统规则的公告(2019年第66号)[EB/OL]. (2019-08-27)[2019-09-23].
http://www.nmpa.gov.cn/WS04/CL2138/357713.html.
[3] Institute of Medicine(US) Committee on Quality of Health Care in America. To err is human:building a safer health system[M]. Washington DC: National Academies Press(US), 2000.
[4] US Food and Drug Administration. Uniqueiddentification for medical devicesfinal report[EB/OL]. (2006-03-22)[2019-09-24].
http://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/UniqueDeviceIdentification/ucm054169.htm.
[5] US Food and Drug Administration. Food and Drug Administration Amendments Act (FDAAA) of 2007[EB/OL]. (2007-09-27)[2019-09-24].
http://www.fda.gov/Regulatory-information/selected-amendments-fdc-act/food and drug-administration-amendment-act-fdaaa-2007.
[6] US Food and Drug Administration. Food anf Drug Administration Safety and Innovation Act (FDASIA)[EB/OL]. (2012-07-09)[2019-09-24].
http://www.govinfo.govinfo.gov/content/pkg/PLAW-112publ144/pdf/PLAW-112publ144.pdf.
[7] US Food and Drug Administration. Global Unique Device Identification Database (GUDID) Enhancements and Fixes[EB/OL]. [2019-09-24].
http://www.fda.gov/medical-devices/global-unique-device-identification-database-gudid/gudid-enhancements-and-fixes.
[8] Association for Heahhcare Resources & Materials Managment (AHRMM). Learning UDI community (LUC) [EB/OL]. [2019-09-24].
http://www.ahrmm.org/resources/learning-udi-community

来源:中国医药导刊


