您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-05-11 09:37
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:16条资讯,阅读时长约:3分钟 」
今日头条
君实PD-1治疗尿路上皮癌上市申请获受理。君实生物PD-1抗体特瑞普利单抗(拓益)新适应症上市申请获NMPA受理,用于治疗既往接受过治疗的局部进展或转移性尿路上皮癌(UC)患者。在一项Ⅱ期关键注册临床(POLARIS-03)中,在可评估的148例UC患者中,拓益的总体客观缓解率(ORR)为25.7%,PD-L1阳性患者(46例,31.1%)ORR达到41.3%;OS数据尚未成熟,安全性数据与特瑞普利单抗过往报道基本一致。这也是特瑞普利单抗继黑色素瘤和鼻咽癌后递交上市申请的第三个适应症。
国内药讯
1.科伦盐酸达泊西汀片通过一致性评价。科伦药业4类仿制药盐酸达泊西汀片获国家药监局批准上市,视同通过一致性评价,也成为国内第2家通过一致性评价的该产品。达泊西汀是一种短效选择性5-羟色胺再摄取抑制剂,最初由礼来研发,最初开发适应症是镇痛和抗抑郁,在1998年将专利转手PPD GenuPro公司,开发成为治疗早泄(PE)药物。目前该原研产品持证商为强生子公司ALZA。华铂凯盛生物为该品种首家拿到上市资格的药企。
2.豪森苹果酸舒尼替尼胶囊即将获批。豪森药业4类仿制药苹果酸舒尼替尼胶囊上市申请进入行政审批阶段,有望近期获批。豪森也可能成为继石药后第2家拿到该品种仿制药上市资格的药企。舒尼替尼是一款多靶点受体酪氨酸激酶抑制剂,原研产品由辉瑞研发,用于治疗胃肠间质瘤、肾细胞癌和胰腺神经内分泌瘤成年患者。该药已获批进口中国,商品名为索坦,其2019年全球销售额为9.36亿美元。
3.正大天晴奥贝胆酸片申报上市。正大天晴3类仿制药奥贝胆酸片上市申请获CDE受理。奥贝胆酸是一种法尼酯X受体激动剂,原研产品由Intercept公司开发,于2016年5月获FDA批准用于治疗原发性胆汁性肝硬化,2019年销售额为2.5亿美元。目前,奥贝胆酸原研在中国尚无申报,其用于治疗非酒精性脂肪性肝炎新适应症申请已获FDA优先审评资格,FDA将于今年6月做出投票表决。国内开展该品种临床试验的厂家有恒瑞、倍特、上海复旦张江等。
4.海和生物IDH1抑制剂产品在美获批临床。海和生物与上海药物所共同研发的异柠檬酸脱氢酶-1(IDH1)抑制剂HH2301获FDA临床试验默示许可,拟用于治疗IDH1突变的实体瘤,包括晚期胆管癌、软骨肉瘤和胶质瘤。这是海和生物第三款获FDA批准临床的创新候选药。HH2301在临床前研究中已显示出抗肿瘤活性,在所有测试种属中均有良好的药代动力学性质和安全性。目前中国尚未有该靶点药物获批上市。
5.绿叶地舒单抗注射液向FDA递交IND申请。绿叶制药旗下博安生物的重组抗RANKL单抗注射液(地舒单抗注射液,LY06006/LY01011)向FDA提交临床试验 (IND) 申请。这也是绿叶集团首个于海外提交的生物药申请。LY06006是剂量60毫克/毫升的地舒单抗注射液,为Prolia®的生物类似药,Prolia®已获批用于治疗具有骨折高危风险的绝经后妇女骨质疏松症等多个适应症,其2019年全球销售额为26.7亿美元;LY01011是剂量120毫克/1.7毫升的地舒单抗注射液,为Xgeva®的生物类似药,Xgeva®已获批用于预防多发性骨髓瘤和实体瘤骨转移患者骨相关事件等多个适应症,其2019年的全球销售额为 19.4 亿美元。
6.阿斯利康PD-L1单抗在中国获批2项临床试验。阿斯利康(AstraZeneca)公司PD-L1抑制剂Durvalumab(Imfinzi)在中国获批2项临床试验:联合铂类化疗用于广泛期小细胞肺癌的一线治疗;联合化疗作为手术前新辅助治疗,并在手术后作为单一药物辅助治疗可手术切除的IIA-IIIB期非小细胞肺癌患者。Durvalumab已于2019年12月在中国获批上市,用于在接受铂类化疗同步放疗后未出现疾病进展的不可切除、III期非小细胞肺癌(NSCLC)患者的治疗。目前,该品种在中国共登记了12项临床试验,其中1项针对尿路上皮癌的III期研究入组暂停。
国际药讯
1.吉利德瑞德西韦获日本特殊批准上市。日本厚生劳动省(MHLW)批准吉利德抗病毒药物瑞德西韦(remdesivir,Veklury)上市,用于治疗新冠肺炎重症患者。这项批准是基于由美国过敏和传染病研究所(NIAID)赞助的临床试验、吉利德正在进行的Ⅲ期临床(SIMPLE)以及在同情用药条件下治疗新冠肺炎重症患者的已有数据(其中包括日本的患者)。本月1号,FDA已授予瑞德西韦紧急使用授权,欧洲药品管理局也已启动对瑞德西韦的滚动审评。
2.基于CRISPR技术的新冠病毒检测获FDA紧急使用授权。由张锋教授联合创建的Sherlock Biosciences公司宣布,FDA已授予其基于CRISPR技术开发的Sherlock CRISPR SARS-CoV-2试剂盒紧急使用授权(EUA),用于检测导致COVID-19的新冠病毒。该检测需要在CLIA认证实验室开展,可以高通量检测大量样本,大约一个小时内给出检测结果。这是FDA批准的首款基于CRISPR技术的新冠病毒检测。据悉,该公司同时在开发一种不需要仪器,与怀孕检测相似的简易检测,能够即时迅速检测新冠病毒RNA序列的存在。
3.礼来“不限癌种”RET抑制剂获FDA批准。FDA加速批准礼来旗下Loxo Oncology公司开发的RET抑制剂Retevmo(selpercatinib)上市,治疗非小细胞肺癌(NSCLC)、髓样甲状腺癌(MTC)和甲状腺癌这三种癌症。这些患者肿瘤的RET基因出现融合或者突变。Retevmo是首个获批这类特定癌症群体的精准疗法。此次批准是基于Retevmo在一项治疗三种类型癌症患者的积极临床数据。其中,在经治的RET融合阳性NSCLC成人患者中,患者的客观缓解率为64%,且81%的患者缓解持续时间至少为6个月;在初治的RET融合阳性NSCLC患者中客观缓解率达到84%。
4.Ferring微生物组疗法获积极Ⅲ期临床数据。Ferring Pharmaceuticals和旗下Rebiotix公司联合宣布,其微生物组疗法RBX2660在预防艰难梭菌感染(CDI)的关键性Ⅲ期试验中获积极的初步结果。RBX2660此前已获FDA授予快速通道资格、孤儿药资格和突破性疗法认定。据悉。这一临床开发计划是全球首个获得Ⅲ期临床积极数据的微生物组研究。该研究同时包括一项安全性评估研究,预计这一试验的完整数据将在今年下半年获得。
5.GSK启动GM-CSF抗体治疗新冠肺炎Ⅱ期临床。葛兰素史克(GSK)在clinicaltrials.gov上登记一项Ⅱ期临床试验,旨在使用其在研抗体otilimab治疗新冠肺炎住院患者。Otilimab是一款抗粒细胞-巨噬细胞集落刺激因子(GM-CSF)单抗,目前正在Ⅲ期临床中用于治疗类风湿性关节炎患者。GM-CSF是严重新冠肺炎患者体内炎症水平升高的促炎性细胞因子之一,这项试验将评估注射一剂otilimab治疗新冠肺炎患者的炎症水平的效果。
6.PTC Therapeutics收购生物技术公司Censa。PTC Therapeutics收购致力于开发代谢疾病药物的生物技术公司Censa。Censa开发的CNSA-001(sepiapterin)是BH4天然前体的口服疗法,拟用于治疗苯丙酮尿症(PKU)和其他与四氢生物蝶呤(BH4)生化通路缺陷有关的疾病。目前,CNSA-001用于治疗PKU即将进入Ⅲ期临床开发阶段。根据协议,PTC将向Censa 支付现金约1000万美元和最多85万股PTC普通股作为预付款,和高达2.175亿美元的潜在开发和监管里程碑付款,以及产品的销售额分成。
医药热点
1.吉林新增11例新冠肺炎确诊病例。5月9日0-24时,国内新增12例新冠肺炎本土确诊病例,其中吉林省11例,湖北省1例。吉林新增确诊11例均与5月7日舒兰市确诊的1例本土病例(舒兰市人,女,45岁,舒兰市公安局洗衣工)有关。该病例无省外居住史、活动史,暂时未发现境外、重点省份返吉人员接触史,感染成谜。目前有关部门正在通过流行病学调查等多种方法对其感染来源进行追踪调查。
2.FDA撤回多家中国N95口罩生产商在美销售许可。FDA在当地时间5月7日撤销了部分中国口罩制造商的销售许可,原因是这些公司的进口口罩不符合美国国家职业安全健康研究所(NIOSH)测试的N95过滤标准。FDA表示,目前只允许向14家中国公司进口口罩。此前为缓解美国本土口罩等医疗物资的供应短缺的压力,FDA于4月3日针对约80家中国口罩制造商生产的未获NIOSH认证的呼吸器(口罩)授予了紧急使用。
3.羊驼血液抗体有助于消灭新冠病毒。比利时科学家发表于《细胞》杂志上的一项最新研究成果表明,羊驼的抗体可以消灭新冠病毒。研究报告称,比利时一只名为温特(Winter)的普通羊驼参与了一系列有关非典病毒(SARS)和中东呼吸综合征冠状病毒(MERS)的研究,科学家从中发现羊驼体内产生了两种分别用来对抗MERS和SARS的有效抗体,科学家证实这两种抗体同样可以消灭新冠病毒。
股市资讯
【科伦药业】公司获得国家药品监督管理局核准签发的化学药品“盐酸达泊西汀片”的《药品注册批件》。
【天士力】公司拟将其控股子公司天士力生物分拆至科创板上市,公司的股权结构不会发生变化,且仍将维持对天士力生物的控股权。
【通化东宝】(1)同意聘任冷春生担任公司总经理;同意聘任张国栋、张文海、陈红、韩凤军担任公司副总经理,聘任迟军玉为公司总会计师。(2)第九届董事会董事会秘书、总会计师王君业任期届满,不再担任第十届董事会董事会秘书、总会计师职务。在聘任新的董事会秘书之前,由公司董事长冷春代行董事会秘书职责,直至公司聘任新的董事会秘书。
审评动向
1. CDE最新受理情况(05月10日)
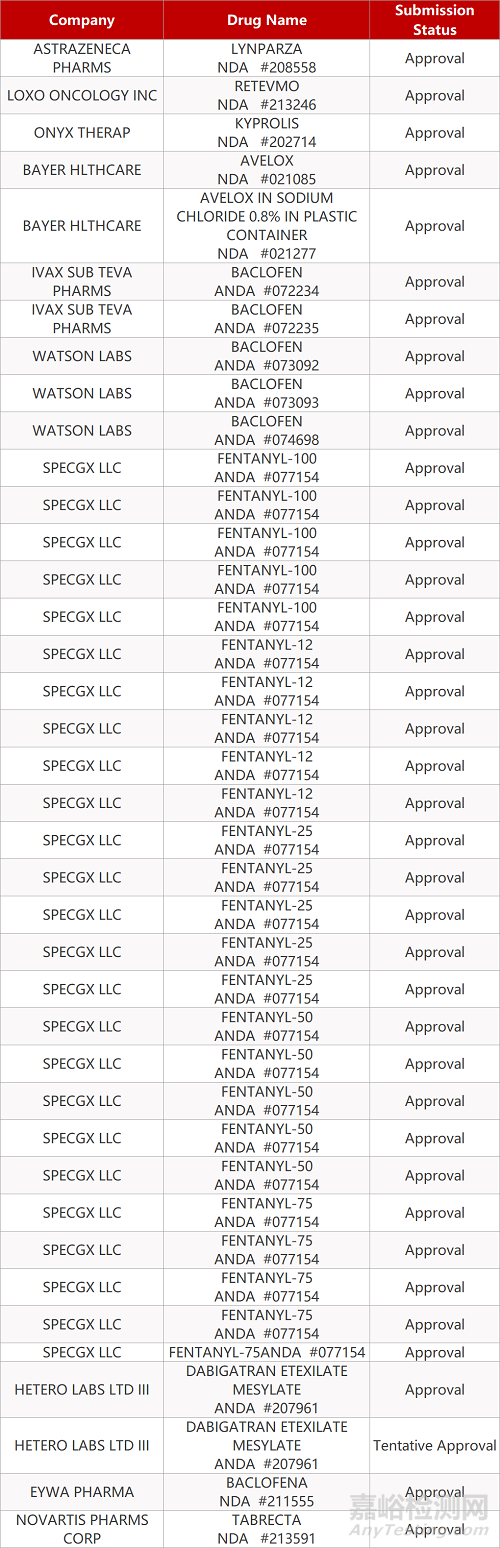
2. FDA最新获批情况(北美05月08日)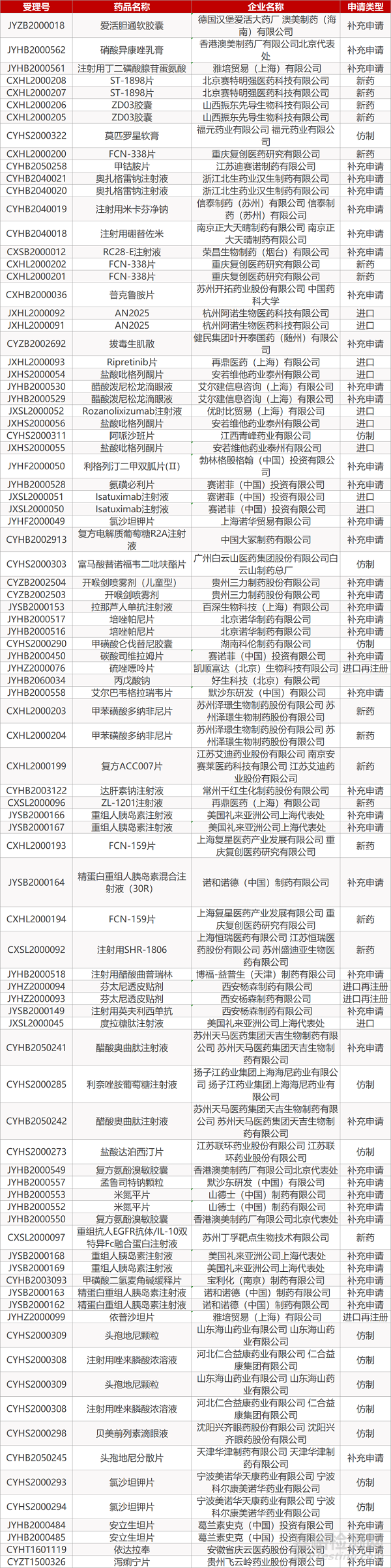
- The End -

来源:药研发


