您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2020-04-02 09:17
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
2分钟出结果,COVID-19血清学检测试剂盒获FDA紧急使用授权。Bodysphere公司开发的创新COVID-19血清学检测试剂盒获FDA授予的紧急使用授权(EUA)。这是一种由专业医务工作者进行的侧流免疫色谱测试,通过检验血液中针对新冠病毒的IgG抗体和IgM抗体,发现COVID-19患者或曾受新冠病毒感染的患者。这一检测具有91%的临床特异性和99%的临床灵敏度。检测结果最快可以在2分钟获得。
1.GSK贝利尤单抗新适应症申报上市。GSK的贝利尤单抗(Belimumab,Benylsta/倍力腾)用于治疗狼疮性肾炎(LN)的新适应症上市申请获国家药监局受理。贝利尤单抗是60年来首个红斑狼疮新药,2019年7月获批在国内上市。在一项448例LN患者参与的III期临床BLISS-LN中,接受贝利尤单抗与标准疗法的有效应答患者数量显著高于接受安慰剂与标准疗法的患者数量。(43%vs32%,p=0.0311),达到主要肾脏疗效应答终点(PERR)。
2.复宏汉霖重组抗EGFR人源化单抗I期临床成功。复宏汉霖重组抗EGFR人源化单克隆抗体注射液在评估其治疗标准治疗耐药的转移/复发性上皮瘤的I期临床试验中显示了良好的安全性及耐受性,至临床试验第28天患者耐受达800mg,且未检测到剂量限制性毒性和最大耐受剂量;药代动力学结果显示,单次及多次给药的暴露呈剂量依赖性,且在高剂量组中出现累积;晚期实体瘤患者中观察到肿瘤应答。
3.Keytruda在中国获批前列腺癌临床试验。3月31日,默沙东帕博利珠单抗注射液在中国获批一项临床试验,拟用于治疗前列腺肿瘤。据悉,默沙东已经启动3项针对Keytruda治疗前列腺癌的关键性III期临床研究,包括Keytruda联合泼尼松、奥拉帕利和恩扎卢胺。目前,这3种组合疗法在I/IIb期临床中均有积极疗效。在中国,默沙东针对帕博利珠单抗已开展了22项临床试验,适应症包括肝细胞癌、子宫内膜癌、食管癌和头颈癌等。
4.天士力养血清脑丸AD新适应症临床申请获批准。天士力养血清脑丸拟用于治疗阿尔茨海默病(AD)的临床试验申请获国家药监局批准。养血清脑丸系天士力心脑血管领域重要品种之一,为养血清脑颗粒改剂型品种,2006年获批上市,功能主治为养血平肝,活血通络。用于血虚肝旺所致头痛,眩晕眼花,心烦易怒,失眠多梦。已完成的临床前药效学试验表明,养血清脑丸具有改善学习和认知障碍的药理作用,提示对AD患者可能会有较好的临床受益。
5.腾盛博药合作开发新冠病毒中和抗体。腾盛博药联手清华大学、深圳市第三人民医院合作开发全人源化新冠病毒中和抗体。清华大学张林琦教授和深圳市第三人民医院张政教授的联合团队,已从COVID-19康复患者中发现多款强力单克隆中和抗体。这些抗体有可能成为新冠病毒感染的潜在疗法,相关研究已发表在预印本网站BioRxiv上。三方合作将加快疗法开发速度,将从选择主打候选疗法到启动人类临床试验的研发时间缩短到6个月,甚至更短。
6.中国生物2019年财报公布。3月30日,中国生物制药公布2019年度业绩,公司实现营业收入约242.34亿元,同比增长约16.0%;归属于母公司持有者应占盈利约27.07亿元,同比下降约70.1%。中国生物在公告中称,归属于母公司持有者应占盈利下降仅因缺少去年取得的大额一次性分阶段收购收益,新产品销售占公司总收入约20.7%。报告期内,抗肿瘤药物2019年实现销售收入54.3亿元,占中国生物制药总收入22.4%。
1.首款靶向BCMA的CAR-T疗法申报上市。百时美施贵宝(BMS)和bluebird bio公司联合开发的CAR-T疗法idecabtagene vicleucel(ide-cel,又名bb2121)已向FDA递交了生物制品许可申请(BLA),用于治疗复发/难治性多发性骨髓瘤(R/R MM)患者。ide-cel也是首款申报上市的靶向BCMA的CAR-T疗法。在一项Ⅱ期临床KarMMa中,在可评估的128例R/R MM患者中,ide-cel的客观缓解率达73.4%,完全缓解率达31.3%。在中位随访时间为11.3个月时,这些患者的无进展生存期达到8.6个月。
2.Akero公司NASH新药达到Ⅱ期临床终点。专注于研发非酒精性脂肪性肝炎(NASH)和其他严重代谢疾病药物的生物技术公司Akero宣布,其主要候选药物--长效FGF21类似物AKR-001,在治疗NASH患者的Ⅱa期临床试验BALANCED中,达到第12周的疗效终点,使患者肝脏脂肪水平与基线相比降低超过60%,达到统计学意义的显著减少。该研究同时也达到肝脏脂肪相对减少的次要终点,其中50 mg和70 mg剂量组均实现高于70%的相对减少。
3.VBI Vaccine合作开发“广谱”冠状病毒疫苗。VBI Vaccine公司将与加拿大国家研究委员会(NRC)合作开发“广谱”冠状病毒候选疫苗,旨在同时预防COVID-19,SARS综合征和MERS综合征。VBI公司在病毒疫苗方面具有丰富的经验,其3价乙肝病毒疫苗Sci-B-Vac已在以色列获批,并在美国、欧洲、和加拿大完成了Ⅲ期临床研究。该公司的包膜病毒样颗粒(eVLP)技术平台能够开发模拟靶标病毒的eVLP,激发强力免疫反应。加上NRC设计的独特新冠病毒抗原和检测开发能力,这一合作有望在第四季度产生用于进行临床试验的候选疫苗。
4.礼来与Sitryx公司达成研发合作。礼来和生物医药公司Sitryx达成全球独家许可和研发合作,将共同开发4种由Sitryx发现的用于自身免疫性疾病的临床前治疗药物。根据协议,Sitryx公司将获得5000万美元预付款,1000万美元的股权投资,可能高达8.2亿美元的开发里程碑付款以及商业里程碑付款和特许权使用费;Sitryx负责药物的开发,礼来则负责提供资金支持,并推进药物的临床开发和商业化。
5.Vir Biotechnology与Generation Bio达成研发合作。Generation Bio与Vir Biotechnology公司达成合作研发协议,使用Generation Bio公司的非病毒基因疗法技术平台,扩展Vir的在研新冠病毒抗体的疗效和使用范围。Generation Bio公司的封闭DNA(ceDNA)技术使用脂质纳米颗粒(LNP)将转基因递送到患者细胞的细胞核中。在细胞核中ceDNA不会整合到细胞的基因组中,并且能够维持稳定、高水平的蛋白表达。这一技术可能维持蛋白表达长达数年。
6.FDA结束对诺华Zolgensma违规行为的调查。经过长达7个月的调查后,FDA决定不对诺华基因疗法Zolgensma篡改数据的违规行为进行监管处罚。FDA将其检查结果归类为“Voluntary Action Indicated(自愿采取措施进行改进),VAI”。Zolgensma是FDA去年5月批准的全球首个治疗脊髓性肌萎缩症(SMA)的基因疗法。去年8月,FDA指出,诺华提交的申请中含有篡改数据,并且直到Zolgensma获得批准一个月后才通知FDA。FDA曾对诺华纂改数据以及延迟报告十分不满,并表示会对其进行严肃调查。
1.COVID-19患者治愈后“复阳” 原因或已查明。发表在预印本网站medRxiv的一项最新研究表明,目前商用试剂盒检测带来的假阴性可能是导致治愈的COVID-19患者“复阳” 的原因。研究人员分析了262例已出院的COVID-19患者,14天的随访结果发现,有38例“复阳”患者。此外,研究人员在使用“CRISPR基因编辑专家”张锋实验室的SHERLOCK试剂盒检测后发现,目前商业试剂盒检测结果为阴性的24个样品中,有18个样本呈阳性。这项研究结果表明,已治愈的患者仍可能携带新冠病毒,为恢复期COVID-19患者的有效管理提供了关键信息。
2.31省区市新增COVID-19无症状感染者130例。国家卫健委从4月1日起在每日疫情通报中增加了无症状感染者的报告、转归和管理情况。在4月1日的首次通报中,31省区市新增无症状感染者为130例,当日转为确诊病例2例,当日解除隔离302例。新冠病毒无症状感染者是指无发烧、咳嗽等症状,也没有临床可识别的症状和体征,但是呼吸道等标本新冠病毒病原学检测是阳性者。此类感染者有4个发现途径:密切接触者的医学观察、聚集性疫情的调查、传染源的追踪、部分有境内外新冠肺炎病例持续传播地区的旅游史或者居住史人员进行检测。
【太极集团】控股子公司西南药业近日收到国家药监局核准签发的盐酸吗啡缓释片(24h渗透泵型)的《临床试验通知书》。
【迈瑞医疗】(1)2019年度实现营业收入165.56亿元(20.38%),实现归母净利润46.81亿元(25.85%),扣非归母净利润46.15亿元(25.04%)。
【博晖创新】控股子公司河北大安收到石家庄市发改委拨付的550万元补助。
1. CDE最新受理情况(4月01日)
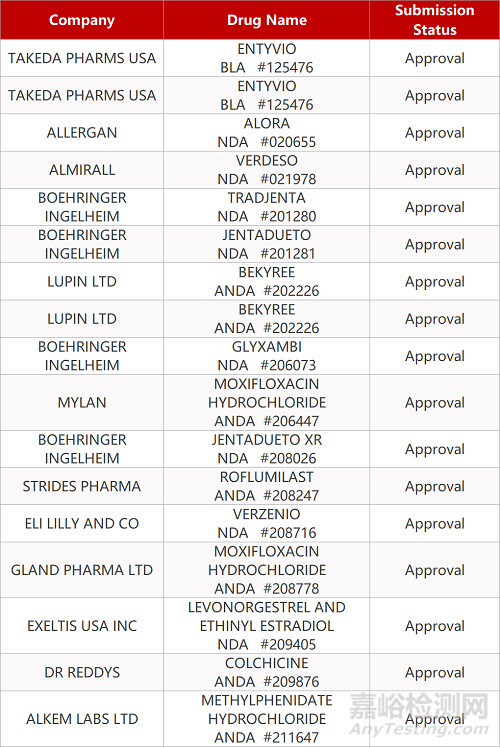
2. FDA最新获批情况(北美3月31日)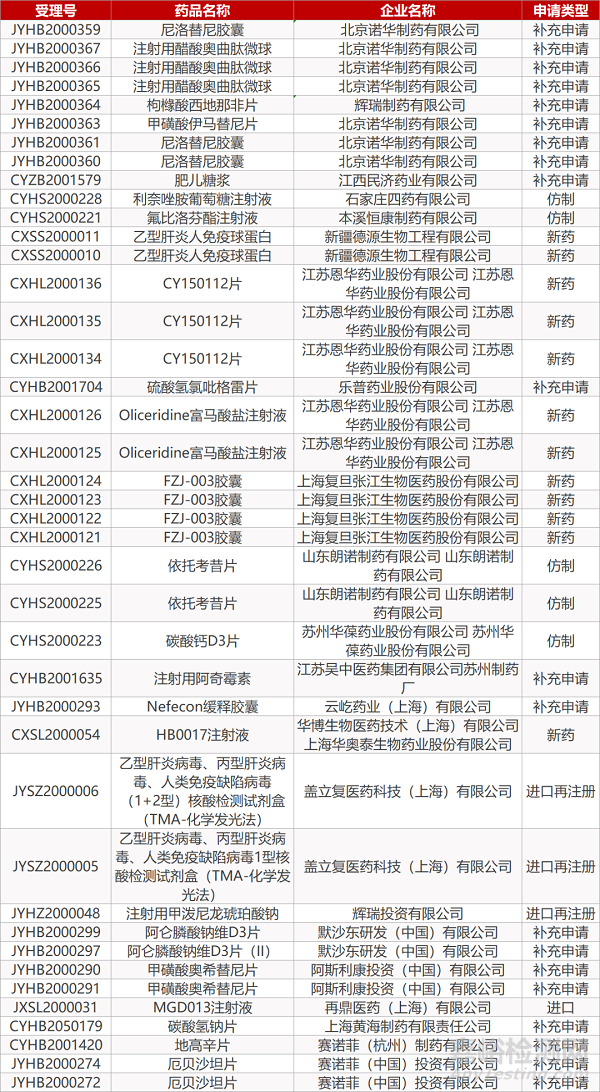
- The End -

来源:药研发


