您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-12-12 09:11
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
海正药业阿达木单抗即将获批上市。海正药业阿达木单抗注射液的上市申请审评状态进入"审批完毕-待制证"阶段,这是继首款国产阿达木单抗注射液(格乐立,百奥泰)获批之后,第2款即将获批的国产阿达木单抗生物类似药。阿达木单抗原研药为艾伯维的修美乐。自2002年上市以来,修美乐已连续7年位居全球最畅销药物榜单首位。2010年,修美乐获批进入中国,4个适应症分别为类风湿关节炎、强直性脊柱炎、斑块状银屑病以及多关节型幼年特发性关节炎。目前修美乐已以1290元的医保支付标准入围国家医保目录。
国内药讯
1.正大天晴苯达莫司汀获批上市。正大天晴新3类仿制药苯达莫司汀获国家药监局批准,用于治疗非霍奇金淋巴瘤(NHL)。苯达莫司汀是一种嘌呤类的烷化剂,该药原研药已在美国获批用于治疗慢性淋巴细胞白血病(CLL)患者,以及患有惰性B细胞NHL并在接受利妥昔单抗或含利妥昔单抗方案治疗期间或治疗后6个月内出现病情进展的患者,持证商为梯瓦。该原研药已于2018年12月获批进口中国,商品名:存达,适用于在利妥昔单抗或含利妥昔单抗方案治疗过程中或者治疗后病情进展的惰性B细胞NHL。
2.艾力斯三代 EGFR-TKI申请上市。艾力斯生物自主研发的1类新药甲磺酸艾氟替尼(AST2818)的上市申请获国家药监局受理。AST2818是新型的第三代不可逆、选择性的EGFR-TKI靶向药。一项Ⅰ/Ⅱ期临床评估AST2818治疗经第一代或第二代EGFR-TKI治疗后进展的局部晚期或转移性非小细胞肺癌患者(T790M突变阳性)的疗效。结果显示,在剂量拓展组的116例患者中,独立评审委员会评估的客观缓解率高达76.7%(89/116;95%CI:68.0%~84.1%),疾病控制率为 88.1%(96/116);中位缓解持续时间尚未达到。
3.基石PD-L1单抗治疗淋巴瘤完全缓解率达33.3%。基石药业在ASH年会上公布其在研抗PD-L1抗体CS1001单药治疗复发或难治性结外自然杀伤细胞/T细胞淋巴瘤的Ⅱ期临床积极结果。在30例可评估患者中,经研究者评估的ORR为43.3%。其中10例(33.3%)患者达完全缓解,且仍在持续缓解中。以一年的总生存率来看,初步数据为72.4%(95% CI:52.0%-85.2%)。在该患者群体中,CS1001的耐受性良好。
4.亘喜生物公布3款CAR-T疗法临床进展。亘喜生物在ASH年会上公布了FasTCAR-19、Dual CAR-19-22和Dual CAR-BCMA-19三款CAR-T疗法的最新临床进展。FasTCAR-19在治疗B细胞急性淋巴细胞白血病(B-ALL)患者中取得了97.1%的完全缓解,91.4%达到最小残留病灶阴性完全缓解(MRD- CR);靶向CD19与CD22的CAR-T疗法Dual CAR-19-22在治疗B-ALL的临床中,Dual CAR-19-22中、高剂量组的16例患者中15例(93.8%)在第28天达完全缓解,并证实为MRD- CR;而靶向CD19与BCMA的Dual CAR-BCMA-19,在体内和体外实验结果均证明能有效清除多发性骨髓瘤(MM)肿瘤细胞,首次人体试验也具有良好的安全性和响应率。
5.信达生物/驯鹿医疗的BCMA CAR-T取得100%客观缓解率。信达生物和驯鹿医疗在ASH年会上,公布其双方共同研发的全人源BCMA CAR-T(信达研发代号:IBI326;驯鹿医疗研发代号:CT103A)治疗复发/难治性多发性骨髓瘤的最新临床数据。在已完成的18例经典Ⅰ期爬坡试验中,可评估的患者有17例,客观缓解率达100%。此外,70.6%的患者达完全缓解,88.2%的患者获得非常好的部分缓解。在最低剂量组,该疗法也达到100%的ORR。安全性总体可控且无神经毒性。
国际药讯
1.赛诺菲补体C1s抑制剂Ⅲ期临床达主要终点。赛诺菲C1靶向抗体药物sutimlimab治疗原发性冷凝集素病(CAD)的关键III期临床CARDINAL(NCT03347396)达到预设主要终点。54%的患者达到复合终点标准,62.5%的患者实现血红蛋白水平≥12g/dL或相对基线增加≥2g/dL,71%的患者在第5周后维持无输血。在治疗评估时间点,血红蛋白的总体平均增加量为2.6g/dL,入组研究的24例患者中有83%(n=20)达到临床显著的血红蛋白平均增加量≥1g/dL。赛诺菲计划向FDA提交sutimlimab的上市申请。sutimlimab此前已获FDA授予突破性药物资格,在美国、欧盟和日本均获授予孤儿药资格。
2.BMS急性髓系白血病新药达Ⅲ期终点。百时美施贵宝在ASH年会上,公布其DNA甲基转移酶抑制剂CC-486作为维持疗法,在治疗急性髓系白血病关键性Ⅲ期QUAZAR AML-001中的积极结果。在中位随访时间为41.2个月时,与安慰剂相比,CC-486治疗组中患者的总生存期得到显著改善,CC-486组的中位OS为24.7个月,而安慰剂组为14.8个月,达主要终点。治疗组中位无进展生存期为10.2个月,而安慰剂组为4.8个月。此外,CC-486组患者的健康相关生活质量(HRQoL)评分较基线时也得以保持,达关键性次要终点。BMS计划明年上半年递交其新药申请。
3.CD47靶向疗法初步临床结果积极。在ASH年会上,Forty Seven公司公布其CD47抗体magrolimab与azacitidine组成的联合疗法,在治疗骨髓增生异常综合症(MDS)和急性髓系白血病(AML)患者的Ⅰb期试验的积极结果。在MDS患者亚组中,患者的总缓解率(ORR)达92%,其中50%的患者达完全缓解(CR);在AML患者亚组中,患者的ORR达64%,其中41%的患者达CR,14%的患者达完全缓解兼完全血细胞计数缓解(CRi);两组患者的平均缓解时间为1.9个月,该组合疗法的疗效显著优于azacitidine的单药治疗。magrolimab此前已获FDA授予治疗MDS和AML患者的快速通道资格。
4.吉利德CAR-T疗法KTE-X19进展积极。吉利德旗下Kite Pharma在ASH年会上,公布其靶向CD19的CAR-T疗法KTE-X19,在治疗复发/难治性套细胞淋巴瘤(MCL)的关键性Ⅱ期临床ZUMA-2中获积极结果。在60例可评估MCL患者中,67%达完全缓解。在中位随访时间为12.3个月时,57%的患者缓解仍然得到维持。最初接受治疗的28例患者(随访时间至少为24个月)中,43%的患者仍然活着。12个月无进展生存率和总生存率估算分别为61%和83%。吉利德预计在年底向FDA递交其上市申请。KTE-X19曾获FDA授予的突破性疗法认定和EMA授予的PRIME药品认定。
5.强生与Xbiotech公司达成合作协议。强生以7.5亿美元与Xbiotech达成合作协议,获得Xbiotech在研IL-1α抗体Bermekimab在皮肤科领域适应症的全球权益,根据协议,强生将负责Bermekimab治疗特应性皮炎和化脓性汗腺炎的Ⅱ期临床研究,如果强生开发Bermekimab在皮肤科以外的适应症,则需再支付额外的费用。XBiotech公司专注于发现及开发治疗各种不同疾病的True Human单株抗体,其主要在研Bermekimab有望被开发用于治疗多种肿瘤(结直肠癌、非小细胞肺癌、胰腺癌)、多种皮肤疾病(银屑病、化脓性汗腺炎、特应性皮炎、痤疮、硬皮病)以及外周血管性疾病和2型糖尿病等。
6.赛诺菲退出心血管和糖尿病领域。赛诺菲新任CEO Paul Hudson宣布新的战略框架,赛诺菲将调整为三个核心的全球业务单元:特药(免疫、罕见病、血液、神经、肿瘤)、疫苗、普药(糖尿病、心血管和成熟药品)。主要战略变更是退出糖尿病、心血管疾病的研发。赛诺菲计划将IL4α受体抗体Dupixent打造成百亿美元的支柱产品,集中发展6种针对未满足临床需求并可能改变临床实践的在研产品(Fitusiran、BIVV0013、Venglustat、SERD(’859)、Nirsevimab和BTKi(’168))。而疫苗和中国市场都将成为赛诺菲未来增长的重要驱动力。Dupixent单抗已于2017年获FDA批准用于治疗中重度特应性皮炎、鼻息肉和哮喘。
医药热点
1.15位医药卫生工作者获吴杨奖。第二十届吴阶平—保罗·杨森医学药学奖(吴杨奖)获奖名单公布,中国医学科学院药物研究所于德泉获特殊贡献奖,其他14位获奖者分属4个领域。基础医学:清华大学董晨和北京大学李毓龙。临床医学:首都医科大学附属友谊医院薛富善、山东省皮肤病性病防治所张福仁、华西医院李为民、浙大附一院梁廷波、北京协和医院沈建雄、首都医科大学附属天坛医院王硕。药学领域:上海药物所果德安、四川大学秦勇、清华大学杨茂君、华西第二医院张伶俐。公共卫生:汕头大学李丽萍和中国疾控制中心施小明。
2.33%美国人因无法负担医疗费拖延治疗。据美国《世界日报》报道,民调机构盖洛普(Gallup)公布最新调查显示,25%的民众遭遇重大伤病时,因为无法负担昂贵的医疗费用被迫延后治疗。调查指出,2018年这一比率为19%,一年后却增加了六个百分点。而上一次的高点出现在2014年,当时有22%的美国人表示,自己或家中某个成员有面临这样的情况。此外,2019年有8%的美国人表示,家中有人罹患的疾病虽然属于轻症,但仍选择延后治疗,这使整个延后治疗的人口比率提升到33%,对比2018年增加四个百分点。
3.尘肺病重点行业工伤保险将扩面。国家卫健委等部门联合发布《关于做好尘肺病重点行业工伤保险有关工作的通知》。《通知》要求,从2020年开始,在煤矿、非煤矿山、冶金、建材等尘肺病重点行业开展为期3年的工伤保险扩面专项行动,和开展尘肺病重点行业工伤预防专项行动。工伤保险方面原则上做到应保尽保。各地人力资源和社保部门要有针对性地制订扩面专项行动工作计划,加大扩面工作实施力度,将尘肺病重点行业职工依法纳入工伤保险保障范围。
【通化东宝】公司的甘精胰岛素注射液3ml、10ml获得《药品注册批件》,药品批准文号:国药准字S20190041、国药准字S20190042。
【昭衍新药】1)公司收购美国Biomere公司100%股权的交易完成交割,Biomere公司成为公司的间接全资子公司。2)公司拟与广州市开发区管理委员会合作投资建设昭衍(广州)新药评价中心项目,总投资规模约为人民币11亿元,项目建设期预计24个月,2023年投入运营。
【华大基因】控股股东深圳华大控股及其下属企业华大集团将参与“阿布扎比全民基因组计划”,并提供基因测序技术和平台服务。
审评动向
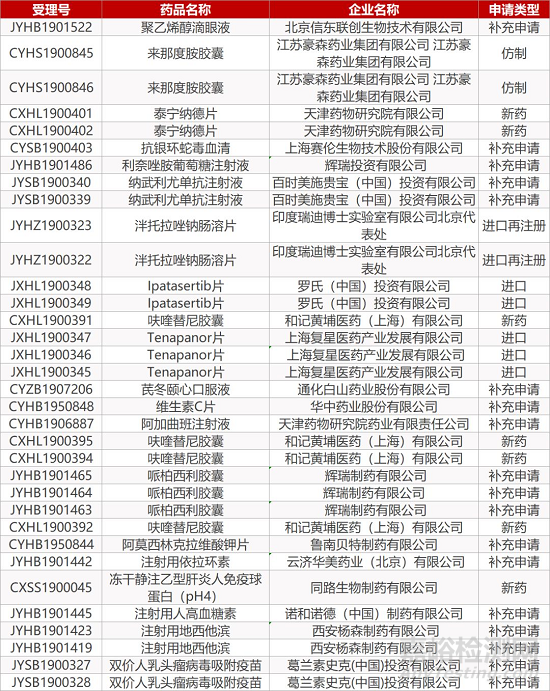
1. CDE最新受理情况(12月11日)
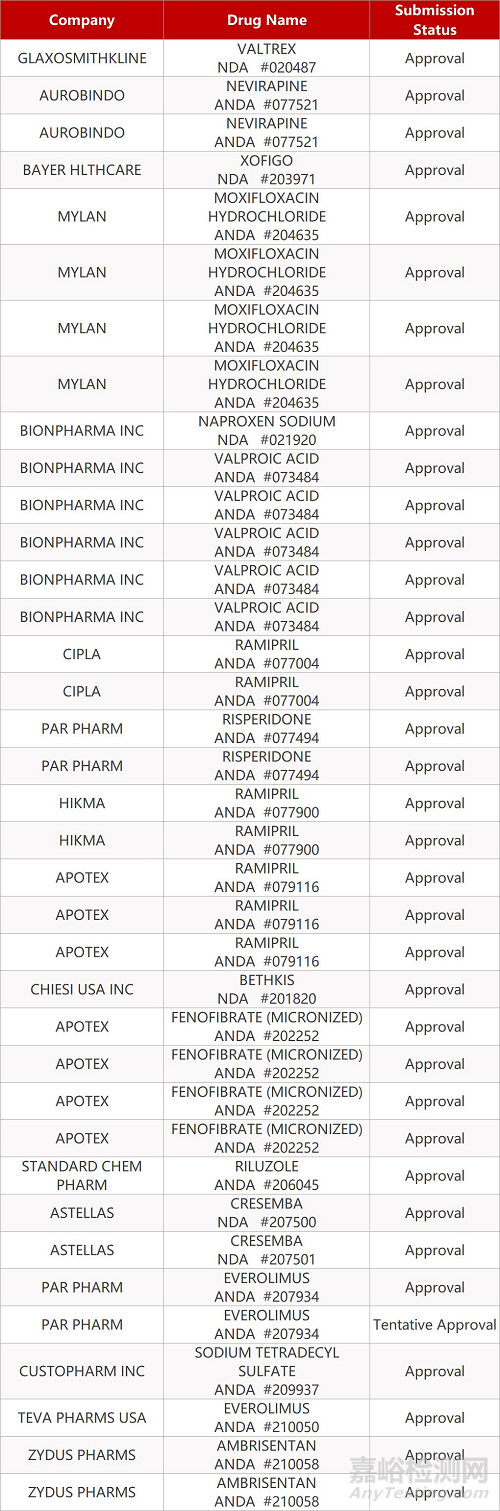
2. FDA最新获批情况(北美12月10日)

来源:药研发


