您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-12-04 14:40
1997年1月1日批准雌二醇贴剂以来,一共批准628个批准文号,涉及114个活性成分(包括中药),总体来看,贴剂上市的数量不多,属于较为偏门的剂型。近年来随着一致性评价政策和药品集中采购等政策实施,国家越来越重视药物的差异化,关注药物的合理运用,促进了国内企业对贴剂的研发热度,如何快速立项贴剂,进入该领域是值得思考的问题。
贴剂的仿制药立项
目前国内上市的化药贴剂的有效批文有72个,涉及36个活性成分,可供仿制的品种不多。自从实施“带量采购”的相关政策后,取消了药物中间商的差价,药品的销量直接由采购量决定,故企业在立项时更多的关注药品的竞争程度,同时原研品是否进入国内市场,在很大程度上市也影响着仿制药的开发难易程度,根据上述情况,分为如下两类情况进行分析。
1 国内未上市的仿制药,包括原研品
这类产品竞争程度最小,一旦仿制上市几乎独占市场,但在仿制方面也有一定的难度:
信息方面,由于原研品未在国内上市,一般的企业难以获得全面的信息,有一定的开发难度,列如用于治疗凝血异常的纤维蛋白贴剂,由EthiconBioSurgery公司开发,由于纤维蛋白的信息较少,具有一定仿制难度;
临床方面,由于人种(针对白人和黑人)的差异,临床结果存在有许多不确定因素;
市场方面,随着原研公司越来越重视国内市场,在国外销售较好的产品均会考虑在国内上市销售,剩余的未在国内上市的产品的市场潜力值得商榷;
用药习惯方面,国外贴剂上市时间长治疗领域广,很多领域在国内还没有贴剂的产品,在国内不一定能够接受,例如用于治疗偏头痛的琥珀酸舒马普坦贴剂以及用于治疗精神分类的的阿塞那平贴剂,在国内均没有厂家申报,竞争较小,但是这两个治疗领域在国内还没贴剂产品,其用药习惯是否得到认可还需进一步讨论。
当然,根据企业自身的实力以及产品的具体特点进行分析,这类产品一旦成功立项,带来的收益也是非同小可的。
2 原研在国内上市,但是还没有本土企业上市的产品
原研品在国内已经上市,从某种程度上来说,原研公司已经确认产品在国内的市场价值,在市场容量和临床方面均有一定的优势,同时其信息较为全面和透明,开发难度不大。这对于中小型企业来说,是较为理想的产品。在已经上市的36个活性成分中,有9个品种符合当前的条件,具体如下:
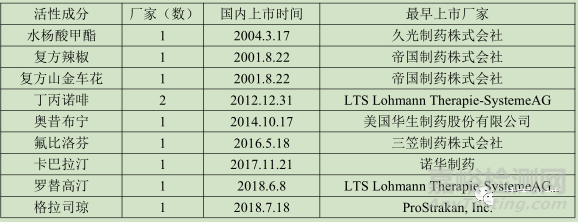
这9个活性成分在国内均有贴剂上市,其中奥昔布宁、卡巴拉汀、罗替高汀、格拉司琼、氟比洛芬等均是近年来上市产品,目前还没有本土企业上市,具有较大的仿制空间。
奥昔布宁由Watson Laboratories, Inc.公司于2014年进口国内上市,其适应症为膀胱过度活跃、尿频、尿急、神经源性尿失禁、自发性逼尿肌不稳定和夜遗尿,生物利用度只有6%,半衰期为2-3小时。相对于国内上市的片剂、胶囊、口服液而言,贴剂通过皮肤给药能够延长药物的治疗时间;通过皮肤直接进入血液,能够避免首过效应,提高药物的生物利用度;最后对于儿童而言,贴剂在顺应性方面要优于口服制剂,故奥昔布宁贴剂更加的符合当前的药物使用,能够顺应国家目前的相关政策,具有较大的开发价值。
卡巴拉汀贴剂(利斯的明透皮贴)是由诺华制药开发,用于治疗轻中度阿尔茨海默病,该病主要集中在老年人,尤其是患有阿尔茨海默病的老年人在吞服方面具有较大困难,开发成贴剂在用药方面具有显著的提高,同理罗替高汀也具有同样的优势。
丁丙诺啡为为阿片受体部分激动剂。镇痛作用强于哌替啶,起效慢,持续时间长。国内的贴剂大部分集中在镇痛抗炎方面,类似的芬太尼透皮贴已在国内上市多年,得到社会的认可,故丁丙诺啡的贴剂上市也能带来一定的市场。
氟比洛芬为国内优秀的非甾体抗炎药,其疗效和安全性已经得到社会认可,其在国内有注射剂、片剂、缓释片等剂型上市,贴剂在很大程度上带来使用的便利性,尤其是在治疗类风湿性关节炎方面,采用贴剂能起到更好的靶向效果,该品种与2017年销售额达到6亿,具有非常大的市场空间。
格拉司琼最初是由英国 Beecham公司开发于80年代中期。用于放于放射治疗、细胞毒素类药物引起的恶心和呕吐。化疗、放疗引起的恶心呕吐一直是令医生和患者烦恼的严重副作用之一,目前司琼类的药物已经占据了止吐药的大部分市场。格拉司琼目前上市的有胶囊、口崩片、注射剂三种剂型,通过皮肤给药不仅给患者使用带来方便,在毒副作用方面还具有显著效果,具有较大的市场空间。
贴剂的改良型新药立项分析
贴剂通过经皮吸收,药物必须具有非常好的透皮效果,而且对剂量、适应症、用法用量等具有较严的要求,再加上近年来对于新药的临床优势看得越来越重,没有明显的临床效果,单纯的改变剂型也不一定能够得到药审中心的认可,故贴剂的新药开发难度较大。自2016年重新划分化学药品注册分类以来,一共有四个贴剂新药品种,均为改良型新药,具体如下:
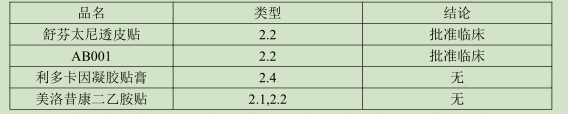
从上述结果分析,舒芬太尼透皮贴透皮贴已经批准临床,其改进程度得到国家局认可。舒芬太尼镇痛作用强,但是持续时间短,其有一定成瘾性,开发成贴剂能够延长其镇痛时间,还能减少一定的副作用。这也反映出,开发出贴剂的新药,除了剂型本身优势外,如果在疗效、毒副作用等方面有一定的改善那么得到认可机会比较大。
AB001目前没有获得其活性成分,利多卡因凝胶贴膏主要是增加新的适应症,其审评尺度大多借助于新的适应症方面,剂型改变所做的贡献比例较小。
美洛昔康二乙胺是在美洛昔康基础上进一步成盐,形成新的化合物,但是没有改变原来活性成分的疗效,成盐后能够增加原活性成分的水溶性。在药效、毒理方面是否有进一步作用未查到相关资料。根据其审评进度来看,于2019年9月18日完成相补充资料审评,是否批准临床暂时未知。
综上所述,从上述已经申报的4个改良型新药分析,仅仅改变给药途径不一定会得到国家局的认可,但是在疗效和毒理方面有进一步改善,那又另当别论。当然上述结论只是根据已经申报的四个改良型新药分析得到,数据相对较少,且均没有实现最终生产,目前下的结论可能会有所偏差,企业在立项时还需要进一步分析。
结 语
近年来贴剂越来越受到重视,国内很多企业将研发方向定在这一方面。然而在技术工艺、制备设备以及辅料组成方面与国外具有较大的差异,在立项贴剂过程中,也需要考虑这方面问题;对于贴剂新药的开发,不仅需要考虑剂型的合理性,还需要考虑在临床方面的优势。最后,随着国内的相关政策不断实施以及患者用药观念的转变,相信贴剂使用越来越广,故立足于贴剂开发有利于企业发展。

来源:药事纵横xinyang