近年来,FDA 批准的创新医疗器械产品数量呈上升趋势。2018 年,PMA(上市前批准)和HDE(人道主义器械豁免)的批准数量为35 个,De Novo(重新分类申请)的获批数量为41 个,通过量显著增加(见图1)。
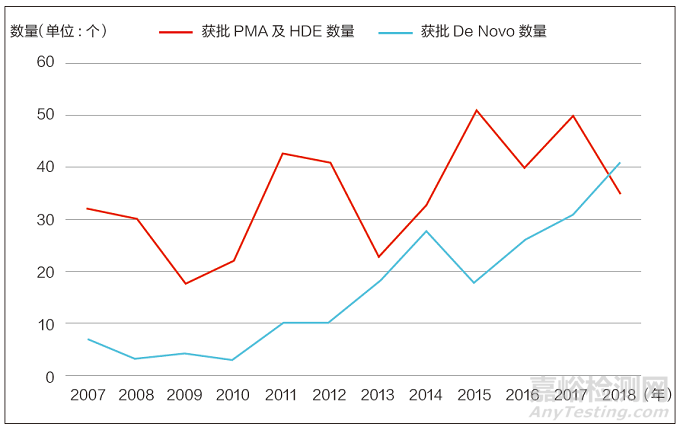
图1 2007 年~2018 年FDA 批准创新医疗器械数量统计
获批的创新医疗器械产品以IVD(体外诊断产品)和心血管类医疗器械为主(见图2)。据EP Vantage 统计,2018 年获批的35个PMA 和HDE 中,心血管类医疗器械产品有13 个,IVD有6 个。此外,2018 年有多款AI 医疗器械产品获批上市,其中既有全球医疗器械巨头的产品,也有小型创新企业的产品。
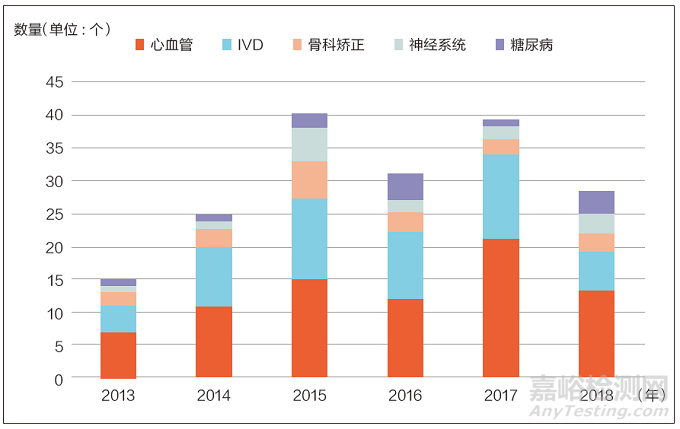
图2 2013 年~2018 年FDA 批准的PMA 和HDE 医疗器械主要治疗领域统计
近年来获批的心血管类医疗器械产品的创新点主要集中在心脏监护类产品,以及对传统经典品种适用范围的拓展上。
心脏监护类产品在心率监测及相关疾病的诊断中起着非常重要的作用。FDA 于2017 年至2019 年批准的16 款心脏监护类产品均旨在更好地实现心电监控和疾病诊断。目前,此类产品正朝着轻便化、高效化、智能化、精准化的方向发展。
第一,轻便化。当前,心脏监护类产品正由体积庞大、可移动性差的设备转向轻便、小巧的设备,很多产品的体积仅有原来的三分之一。此类设备可携带,或通过微创手术植入患者胸内或皮下进行监测。
第二,高效化。以苹果公司的Apple WatchSeries 4为例。该品具有ECG(心电图)监测功能,可在30 秒内完成ECG 读数,显示心脏跳动波形。
第三,智能化。此类设备可实时上传数据至APP 及其他平台中,以便护理人员或医生持续观察,且能降低人力成本。
第四,精准化。早期的心脏监护类产品的最大问题是准确度低,而目前获批的新产品可大大提高对心血管疾病的诊断效率。
Impella 心室辅助系统的适应证范围于近年来得到拓展。Impella 依靠微型轴流泵模拟人体生理过程,将血液输送至主动脉,以减轻左心室负荷。2008 年,Impella2.5 获批用于心脏病发作或心脏直视手术后的高风险经皮冠状动脉介入治疗和心源性休克治疗。
Impella 能方便、快捷地植入患者体内,且并发症发生率较低,一经上市便成为热门产品。由于操作难易程度的不同,该系列产品中,Impella2.5 临床应用较多,Impella5.0 主要用于患者的术后支持。
近年来,Impella 系统拓展了适应证:Impella作为严重左心衰竭和高危经皮冠状动脉介入治疗的辅助装置已获批,Impella CP 的智能传感技术用于心源性休克治疗也已获批。
Stryker 公司研发的Trevo Clot Retriever装置于2012 年被FDA 批准,用于无法接受或无响应t-PA 溶栓治疗的急性缺血性脑卒中患者(事件发生后6 小时内)的治疗。2016 年,该产品的适用时间延长至患者脑卒中发生后的24 小时,并被允许与t-PA 治疗一起使用,这使其适用范围得到极大拓展。
冠状动脉支架能够应用的血管直径范围也被刷新。2018 年,美敦力的Resolute Onyx 2.0 mm佐他莫司药物洗脱支架获FDA 批准上市,用于冠状动脉小血管病变的治疗。心脏中有许多位于关键部位的小血管(直径≤ 2.25mm),对于相关病变的治疗极具挑战性,该产品的获批上市使在这些部位应用支架成为可能。
伴随诊断是一种体外诊断技术,能提供有关患者针对特定治疗药物的治疗反应信息,以确定药物是否适用于特定人群。
从全球来看,伴随诊断是IVD 市场中增速最快的细分领域之一。2019 年,伴随诊断领域产品占整个IVD 市场2.9% 的份额,预计2020年,这一比例将达到14%。2017 年,全球伴随诊断领域市场规模为26.1 亿美元,据预测,2016 年~2022 年,这一市场的复合年均增长率将达到22.78%。
据预测,2012 年~2020 年,国内伴随诊断领域市场的复合年均增长率为28%,高于全球平均水平。随着肿瘤研究、靶向药研发的加速,及新的生物标志物的发现,该领域市场将继续扩大。
液体活检是肿瘤早筛的有效方法之一,它是一种通过测定血液中CTC(循环肿瘤细胞)、ctDNA(循环肿瘤DNA)的含量,对肿瘤进行诊断和监测的方法。相对于传统方法(如手术、穿刺等),液体活检具有操作简单、副作用小、患者痛苦小、可重复取样等优势。其主要步骤包括分离、富集和检测。研究对象主要包括外周血循环中存在的CTC、ctDNA、外泌体等。
目前,国内外多家企业正在这一领域布局。Guardant Health、Grail 等企业的产品受到市场的广泛认可,罗氏、凯杰等企业也涉足此领域。国内企业中,艾德生物率先进行相关布局。
技术及大数据应用于医疗行业,以提高诊断效率和服务质量。AI 医疗采用的主要技术包括语音识别、计算机视觉、人机交互、深度学习等。
AI 医疗主要应用于辅助诊疗、医学影像、药物挖掘、健康管理、疾病风险监测等领域。其中,药物挖掘和医学影像领域所占市场份额最大。据麦肯锡预测,2025 年,全球智能医疗行业市场规模将达到254 亿美元,约占全球AI 领域市场总值的1/5。
当前,国内外医疗器械行业均在AI 领域积极布局。国外企业中,IBM 推出的沃森机器人已在多国被用于辅助医生诊断;直觉外科公司开发的手术机器人取得了商业成功;美敦力、GE 医疗、飞利浦医疗、西门子医疗等也在积极推进手术机器人、医学影像自动识别领域的研发。国内企业中,万东医疗、联影医疗等已开发出成熟的AI 医疗产品,且具有清晰的商业模式。
AI 医疗器械产品主要包括检测预警类、辅助诊断类、用药辅助类等。在FDA 批准的AI 医疗器械产品中,检测预警类较多,辅助诊断类、用药辅助类相对较少。
从应用领域来看,糖尿病、心血管和神经疾病领域为AI 医疗器械产品的主要治疗方向。我国企业乐普医疗生产的AI 心电产品也已获批。FDA 探索AI 医疗监管机制
当前,FDA 正积极探索AI 医疗器械审评新框架。今年4 月,FDA 发布一份讨论文件,提出一项针对人工智能/ 机器学习(AI/ML)医疗设备软件的拟议监管框架。在美国,软件类医疗器械的审批和后续更新曾采用“基于风险”的模式,在这一模式下,FDA 要求企业提交有关新版本软件对产品所造成潜在影响的相关资料,并对其详细评估。
此外,FDA 还探索针对低风险AI 医疗产品的全新监管方式——“数字医疗软件预认证计划”。通过这一方式,经过FDA 预认证的开发主体被允许直接销售其AI 医疗产品,而不再需要接受额外审查和繁复的上市前审查。
(本文摘编自王宝亭、耿鸿武主编的《中国医疗器械行业发展报告(2019)》)






