您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-11-01 09:24
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
诺华CAR-T疗法在华获批临床。诺华旗下CAR-T疗法CTL019(Tisagenlecleucel)获国家药监局临床试验默示许可,适应症为复发/难治性侵袭性B-细胞非霍奇金淋巴瘤。CTL019(商品名:Kymriah)2017年8月获FDA批准,成为全球首款上市的CAR- T药物,当时获批用于治疗罹患B细胞前体急性淋巴性白血病(ALL)患者,后来又在2018年5月获批用于治疗复发/难治性弥漫性大B细胞淋巴瘤的成人患者。目前,Kymriah在非霍奇金淋巴瘤、滤泡性淋巴瘤等适应症也正在临床试验中,其中本次国内获批的非霍奇金淋巴瘤适应症在国外已进展到Ⅲ期阶段。国内处在临床中的CAR-T 的企业共有 8 家,进度最快的处于Ⅱ期阶段。
国内药讯
1.君圣泰收获首个中国临床批件。君圣泰自主研发的小分子创新药HTD1801片获国家药监局临床试验默示许可,拟用于治疗原发性硬化性胆管炎(PSC)。这也是君圣泰在中国首个获批的临床试验。此前,HTD1801治疗非酒精性脂肪性肝炎(NASH)和PSC这两项适应症均被FDA授予了快速通道资格,其中PSC还获孤儿药资格认证。HTD1801目前正在美国开展针对NASH,和PSC的II期临床试验,预计2020年公布II期数据。据悉,HTD1801的临床前研究数据将在即将召开的第70届美国肝病研究协会年会上公布。
2.复星子公司5.24万支不合格产品已被召回。复星医药发布公告称,旗下子公司苏州二叶生产的1批次注射用哌拉西林钠他唑巴坦钠(规格:2.25g)不符合规定,不符合规定项目为含量测定。根据公告,该批次产品共计165170支已全部销售,实现销售收入176万元。苏州二叶已及时通知经销企业及使用单位停止该批次产品的销售和使用,并启动问题批次产品的召回程序。目前市场留存的该批次产品共计约5.24万支已被召回。公告表示此次产品不合格是混合设备的底阀出现偶发故障所导致。
3.索元生物启动Pre-IPO融资。精准医疗企业索元生物宣布启动Pre-IPO融资,以支持其从礼来引进的小分子丝氨酸/苏氨酸激酶抑制剂DB102(enzastaurin)用于治疗初发脑胶质母细胞瘤(GBM)的国际Ⅱb期研究。索元生物创立于2012年,该公司通过引进具潜力的候选药物,并利用其独创的生物标记物平台技术发现可预测药物疗效的生物标记物,重新筛选患者以达到提高新药开发的成功率。该公司目前已拥有开发至临床后期的4款1类首创(first-in-class)药物 DB102、DB103、DB104 和 DB105的全球权益。enzastaurin用于一线治疗初治高危弥漫性大 B 细胞淋巴瘤(DLBCL)的Ⅲ期临床正在中美两国开展,
4.泽璟制药科创板首发过会。上海证交所科创板股票发行上市审核信息披露网站公布,泽璟制药首发上会已获通过。据招股书披露,泽璟制药拟募23.84亿元,募集的资金中14.59亿元用于支持新药研发项目的开发,4.25亿元用于新药研发生产中心二期工程建设项目,5.00亿元用作营运及发展储备资金。保荐人为东吴证券。泽璟制药成立于2009年,目前已建立有小分子新药与重组蛋白新药的产品管线,涉及肝癌、非小细胞肺癌、结直肠癌、甲状腺癌等多种癌症和血液肿瘤以及出血、肝胆疾病等多个治疗领域。
国际药讯
1.Alkermes/渤健多发性硬化症新药获FDA批准。Alkermes公司和渤健联合开发的新型口服富马酸盐药物Vumerity(diroximel fumarate)获FDA批准,用于治疗复发多发性硬化症(MS)患者,其中包括临床孤立综合征,复发缓解型疾病,和活跃的继发进展型疾病。Vumerity是一种富马酸盐的前体,在体内能够被迅速转化为富马酸单甲酯。一项名为EVOLVE-MS-2的Ⅲ期研究显示,因不良事件的发生退出试验的患者比例在Vumerity治疗组中为1.6%,而在已获批的富马酸二甲酯疗法Tecfidera的活性对照组中为6.0%;因胃肠道不良事件而退出试验的患者比例在治疗组为0.8%,而在活性对照组为4.8%。
2.安斯泰来白血病治疗药物XOSPATA™获欧盟批准。安斯泰来的第二代FLT3抑制剂XOSPATA™(gilteritinib)获欧盟委员会批准,用于治疗携带FLT3突变的复发/难治性急性髓系白血病(AML)成人患者。该疗法采用Invivoscribe公司与安斯泰来合作开发的LeukoStrat®CDxFLT3Mutation Assay来检测FLT3突变(FLT3mut+)。一项Ⅲ期ADMIRAL研究在复发/难治性FLT3mut+ AML患者中评估gilteritinib与补救性化疗的效果,结果显示,与化疗相比,gilteritinib显著提高患者的总生存期,gilteritinib治疗组患者的平均总生存期为9.3个月,而化疗组为5.6个月。
3.FDA批准史上使用时间最长的激素宫内避孕器。艾尔建与Medicines360公司宣布,FDA已批准Liletta(左炔诺孕酮宫内缓释系统,52mg)的一份补充新药申请,将该产品用于避孕的持续使用时间延长至6年。Litetta是FDA批准使用时间最长的一款激素宫内节育器(IUD),之前已获批防止女性受孕的持续使用时间为5年。一项宫内系统(IUS)III期研究ACCESS IUS的额外数据显示,Liletta在广泛的女性群体中使用持续6年的时间内避孕有效率超过99%。
4.罗氏IL-6抗体上市申请获FDA/EMA接受。罗氏(ROC)旗下基因泰克开发的IL-6抗体satralizumab的上市申请获FDA受理,用于治疗视神经脊髓炎谱系障碍(NMOSD)的成人和青少年患者。同时,欧洲药品管理局(EMA)也受理了satralizumab的营销授权申请,并授予其加速评估资格。一项关键性Ⅲ期SakuraStar研究显示,与安慰剂组相比,satralizumab单药治疗将患者的疾病复发风险降低55%,96周和48周的无复发比例为76.1%和72.1%,而在安慰剂组这一比例为61.9%和51.2%。此外,satralizumab单药治疗将携带AQP4自身抗体的患者疾病复发风险降低74%,96周和48周的无复发比例为76.5%和82.9%,而在安慰剂组这一数字为41.1%和55.4%。
5.TG Therapeutics新一代PI3Kδ抑制剂关键性临床达终点。TG Therapeutics创新口服PI3Kδ抑制剂umbralisib,在关键性Ⅱb期临床UNITY-NHL的滤泡性淋巴瘤(FL)患者队列中,达到试验的主要终点。独立审查委员会(IRC)评估的患者的总缓解率达到预先设定的40-50%标准。研究中umbralisib单药疗法具有良好的耐受性和安全性。详细结果将于未来的医学会议上公布。umbralisib曾获FDA授予治疗边缘区淋巴瘤的突破性疗法认定。
6.Sanifit公司创新疗法达到Ⅱb期临床终点。Sanifit公司具有创新作用机制的特异性钙化抑制剂SNF472,在治疗接受透析的终末期肾病(ESKD)患者的Ⅱb期临床中达主要终点。274例患者接受不同剂量的SNF472或安慰剂的治疗,与安慰剂组相比,SNF472治疗组患者的冠状动脉钙化水平显著降低。SNF472是一种通过阻止羟基磷灰石(HAP)晶体生成来抑制钙化的特异性抑制剂。详细结果将于今年11月召开的美国心脏协会年会上公布。
7.GSK肺结核疫苗Ⅱb期试验结果积极。葛兰素史克和国际艾滋病疫苗行动组织(IAVI)联合宣布,GSK的在研疫苗M72/AS01E在Ⅱb期临床中,显著降低了HIV阴性潜伏性结核感染成人患者的肺结核病(TB)发病率,在接种后3年内的疫苗效力为50%。研究结果已发表在《新英格兰医学杂志》(NEJM)上。候选疫苗M72/AS01E包含根据两种结核分枝杆菌抗原(Mtb32A和Mtb39A)生成的M72重组蛋白,和AS01免疫佐剂系统。这一免疫佐剂系统已在GSK的疟疾和带状疱疹疫苗中使用。
医药热点
1.2万多家基层机构可跨省结算。国家医保局公布最新一期医保跨省异地就医住院医疗费用直接结算公共服务信息。截至2019年9月底,跨省异地就医定点医疗机构数量为22856家,二级及以下定点医疗机构20105家,国家平台备案人数490万,累计结算人次343万。2019年9月,跨省异地就医定点医疗机构新增1032家,其中二级及以下定点医疗机构新增1015家;跨省异地就医直接结算25.3万人次,环比上升1.9%;涉及医疗费用59.9亿元,环比上升1.2%;基金支付35.8亿元,环比上升3.3%,基金支付比例为59.8%;日均直接结算8450人次等。
2.今年流感疫苗供应充足。在国家卫健委的例行新闻发布会上,国家卫健委疾控局副局长贺青华介绍,今年我国流感疫苗总体供应量充足,全国计划供应约2800万剂次;目前批签发量超过2000万剂次,供应各地1700多万剂次,供应量是去年同期的3倍;各地流感接种工作正有序进行,累计接种量超过800万剂次,接种量是去年同期的2倍;部分接种点因扎堆接种而导致供应紧张的情况正在逐步缓解。
3.默沙东HPV疫苗Gardasil供应不足。据FiercePharma网站报道,默沙东本月从美国疾病预防控制中心(CDC)的小儿疫苗库存中借用了Gardasil 9价疫苗,以帮助应对美国对该疫苗的接种需求。该疫苗目前在美国获批用于9-45岁青少年及成人预防某些具有高致癌风险的HPV。Gardasil在第三季度财报中销售额已达13.2亿美元(同比增长27%),仅次于Keytruda产品。“到2023年,将有望增加供应量以满足美国及全球需求”,默沙东首席商务官Frank Clyburn告诉分析师,“随着公司继续匹配并转移供应以满足全球范围内的需求,在未来几年,Gardasil的市场将不断增长。”
股市资讯
.
上个交易日 A 股医药板块 +0.58%
涨幅前三 跌幅前三
海正药业 +9.98% 昊海生科 -23.03%
康 恩 贝 +7.66% 康芝药业 -7.54%
浙江医药 +7.36% 赛升药业 -7.17%
【复星医药】(1)复宏汉霖及汉霖制药研制的HLX11用于转移性乳腺癌、早期乳腺癌治疗获国家药监局临床试验注册审评受理。(2)复创医药研制的FCN-647胶囊用于复发或难治的B淋巴细胞恶性肿瘤治疗的临床试验申请获国家药监局注册审评受理。(3)复宏汉霖研制的注射用曲妥珠单抗用于转移性乳腺癌适应症治疗的III期临床研究已达到预设的主要终点。
【海正药业】全资子公司海正杭州公司将其持有的海正宣泰51%股权通过产权交易所公开挂牌的方式进行对外转让。海正宣泰51%股权对应的评估价值为2,339.51万元,挂牌底价不低于评估价值。
【哈药股份】分公司哈药六厂“盐酸二甲双胍片” 通过仿制药一致性评价。
审评动向
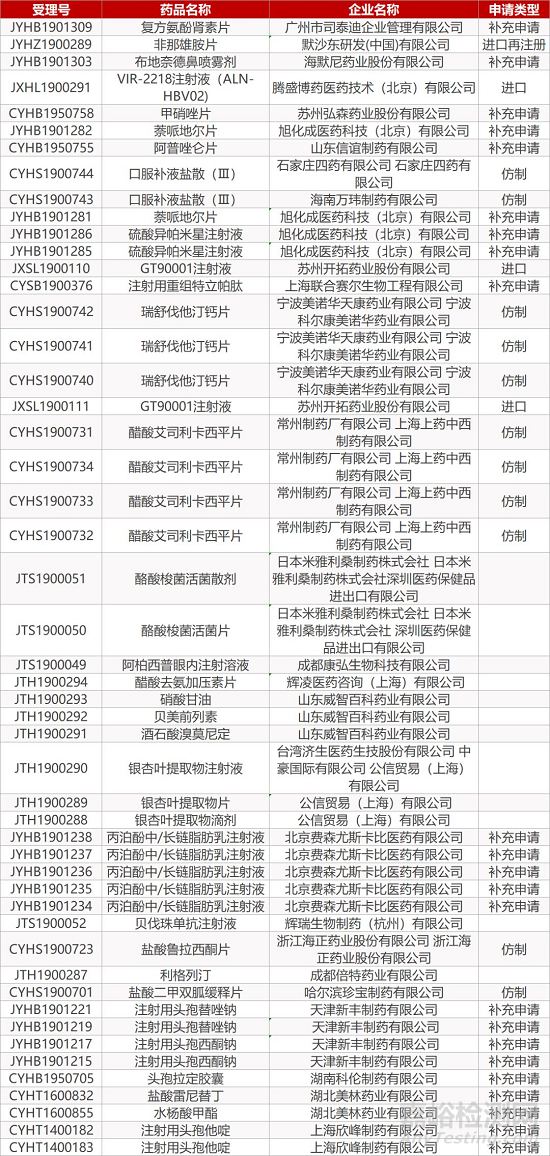
1. CDE最新受理情况(10月31日)
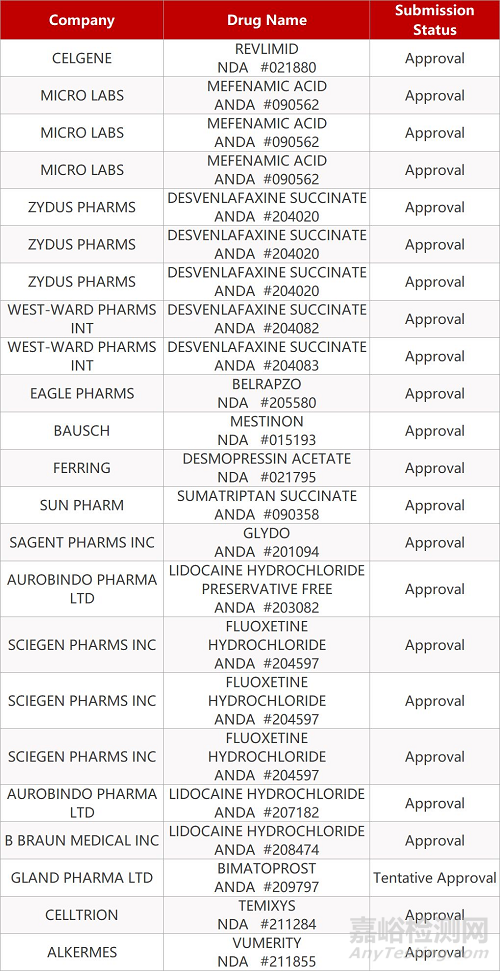
2. FDA最新获批情况(北美10月30日)

来源:药研发


