您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2019-10-18 09:12
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
「本文共:15条资讯,阅读时长约:3分钟 」
今日头条
诺诚健华申请港交所IPO。诺诚健华向港交所提交IPO招股书。诺诚健华是一家专注于自身免疫疾病和肿瘤等药物研发的生物医药公司,目前拥有九种具有成为Best in Class和First in Class潜力的候选药物。其中BTK抑制剂奥布替尼(ICP-022)目前正在中美两国进行注册性临床试验,用于治疗多种B细胞恶性肿瘤及自身免疫性疾病。进度最快的注册性试验针对以下两种适应症:复发/难治慢性淋巴细胞白血病或小淋巴细胞淋巴瘤(CLL/SLL)以及复发难治套细胞淋巴瘤(MCL)。预计将于2019年底在中国提交新药申请。
国内药讯
1.现代制药头孢呋辛酯片通过一致性评价。现代制药旗下国药金石的头孢呋辛酯片(0.5g)通过一致性评价并获国家药监局核发的《药品补充申请批件》。头孢呋辛酯是第二代头孢菌素类抗生素,主要用于治疗由敏感细菌引起的感染性疾病,包括上呼吸道感染、下呼吸道感染、泌尿道感染、皮肤软组织感染、耳鼻部感染、急性无并发症淋病等。目前拥有头孢呋辛酯片(0.5g)生产批文的国内厂家还有苏州中化药品工业有限公司等,国内该品种尚无相同规格药品通过一致性评价。
2.雅创医药原创NASH新药启动美国Ⅰ期临床。雅创医药原创NASH新药HPG1860在美国的I期临床试验完成首组健康志愿者给药。该研究旨在评估HPG1860单次递增剂量和多次递增剂量给药在健康志愿者中的安全性、耐受性、药代动力学和药效学。HPG1860是非胆汁酸结构,高效,高度选择性的完全法尼醇X受体(FXR)激动剂,具有治疗非酒精性脂肪性肝炎(NASH),原发性胆汁性肝硬化(PBC)及原发性硬化性胆管炎(PSC)的潜力。
3.默克MET抑制剂在华获批临床。默克开发的口服MET抑制剂tepotinib片的Ⅱ期单组试验(VISION)获国家药监局批准,适应症为:具有MET外显子14(METex14)跳跃突变或MET扩增的晚期(局部晚期或转移性)非小细胞肺癌(NSCLC)。Tepotinib已获FDA授予突破性疗法认定。一项正在进行的Ⅱ期VISION研究数据显示:经液体活检确认METex14 突变的NSCLC患者中,独立评估委员会(IRC)评估的总体缓解率为50.0%,研究人员评估的为55.3%;经组织活检确认的患者,这两个数字分别为45.1%和54.9%。在中国,已有贝达药业、豪森药业等多家公司布局这一领域。
4.应世生物与罗氏达成全球联合用药临床合作。应世生物旗下的黏着班激酶(FAK)抑制剂IN10018与罗氏旗下的小分子MEK抑制剂Cobimetinib将在全球范围内展开联合用药的临床研究。该研究旨在评估IN0018和Cobimetinib联用治疗葡萄膜黑色素瘤癌症患者的安全性、耐受性以及抗肿瘤疗效。基于合作协议,应世生物将作为该临床试验的发起者,罗氏将向应世生物提供试验所需的Cobimetinib。
5.华海药业两个原料药CEP证书获批准恢复。10月16日,华海药业发布公告称,10月15日晚间公司查询EDQM官方网站获悉,公司的厄贝沙坦原料药和氯沙坦钾原料药CEP证书于2019年10月15日批准恢复,证书编号分别为R1-CEP 2010-033-Rev02和R1-CEP 2010-139-Rev01,上述两个产品也将获得恢复出口欧洲的资格。目前该公司尚未收到书面证书。据悉,该公司2018年厄贝沙坦原料药销售额为8,290元,氯沙坦钾原料药销售额为7,934元。
国际药讯
1.渤健多发性硬化症改良疗法获FDA暂时批准。渤健(Biogen)与Alkermes公司联合开发的复发类型多发性硬化症(MS)新疗法Vumerity(diroximel fumarate)获得FDA的暂时批准。Vumerity是一种具有独特分子结构的口服富马酸盐。一项Ⅲ期临床EVOLVE-MS-2试验中,复发缓解型多发性硬化症患者接受Vumerity或Tecfidera(口服富马酸盐的前体,已获批的MS治疗药物)的治疗。Vumerity在试验的主要终点上的表现显著优于Tecifidera,Vumerity治疗组的患者出现严重胃肠道副作用的天数显著少于Tecifidera组(p=0.0003),而且由于胃肠道副作用退出研究的患者占Vumerity组的0.8%,而Tecfidera组这一数值为4.8%。
2.盐野义新型抗生素获FDA咨询委员会支持。盐野义新型铁载体头孢菌素类抗生素药物cefiderocol获FDA的抗微生物药物咨询委员会推荐,批准该药用于治疗包括肾盂肾炎在内的复杂性尿路感染(cTUI)。一项关键性Ⅱ期临床结果显示,与亚胺培南-西司他丁相比,cefiderocol达非劣效性标准。此外,近日cefiderocol在治疗多重耐药细菌性肺炎患者的Ⅲ期临床试验中,也达到了试验的主要终点。
3.Incyte公司JAK抑制剂达Ⅲ期临床终点。Incyte公司JAK抑制剂Jakafi(ruxolitinib)Ⅲ期试验REACH2获积极结果。该研究评估ruxolitinib治疗类固醇难治性急性移植物抗宿主病(GVHD)的有效性和安全性,其主要终点是第28天时对总体缓解率(ORR)的改善,次要终点包括第14天和56天的ORR,缓解持续时间,总生存率(OS)和无事件生存率。结果显示,试验达主要终点。具体结果将于未来的医学大会上公布。Ruxolitinib已于今年5月获批用于治疗类固醇难治性急性GVHD。
4.礼来IL-10制剂胰腺癌III期临床失败。礼来(Eli Lilly)IL-10制剂pegilodecakin的联合方案治疗胰腺癌Ⅲ期临床SEQUOIA研究失败。该项研究旨在转移性胰腺癌患者中比较pegilodecakin联合FOLFOX(亚叶酸,5-FU,奥沙利铂)与单药FOLFOX的疗效和安全性。主要终点是总生存期,关键次要终点是无进展生存期和客观缓解率。数据显示,pegilodecakin联合疗法并未达到改善总生存期的主要终点;且与FOLFOX单药治疗组相比,联合治疗组最常见的3/4级不良事件发生率更高(差异大于5%),包括中性粒细胞减少、血小板减少等。该研究由原研厂家ARMO在2017年启动。2018年礼来16亿美元收购Armo后接手这个试验。
5.益普生与Blueprint公司达成一项研发合作。致力于开发精准疗法的Blueprint 公司与益普生旗下Clementia 公司达成一项研发协议,双方将共同开发ALK2抑制剂BLU-782,用于治疗进行性肌肉骨化症(FOP)患者。Blueprint 公司开发的BLU-782此前已获FDA授予罕见儿科疾病认定,孤儿药资格以及快速通道资格。根据协议,益普生将利用其在罕见病治疗方面的专业知识和临床基础设施加速BLU-782的开发;Blueprint公司将获2500万美元的预付款,并有权获得高达5.1亿美元的研发、监管、销售里程碑付款以及相应销售额分成。
6.孤儿药公司Alexion收购Achillion。Alexion Pharmaceuticals公司拟以9.3亿美元收购Achillion 公司,获得其口服因子D抑制剂平台,并共同开发治疗阵发性睡眠性血红蛋白尿症(PNH),C3肾小球病(C3G),及其它补体替代途径介导的罕见疾病有效疗法。Achillion是一家处于临床阶段的生物医药公司,专注于发现并开发口服因子D抑制剂。目前,该公司有两款处于临床阶段的药物danicopan(ACH-4471,第一代口服因子D抑制剂)和ACH-5228(第二代口服因子D抑制剂),治疗PNH,C3G以及其它罕见疾病。此外,Achillion还正在开展第三代口服因子D抑制剂的临床前开发工作,预计2020年进入临床阶段。
医药热点
1.《自然》子刊:最新肿瘤免疫疗法研发趋势。纽约癌症研究所的唐钧博士团队在Nature Reviews Drug Discovery上发表一篇综述,对2019年8月和2017年9月的癌症免疫疗法研发管线进行了详细比较。数据显示,癌症免疫(IO)药物研发管线中疗法数目从两年前的2030种扩展到3876种,增长91%;IO疗法的靶点比2017年增加205种达468种,增幅达78%;有5个新靶点晋身15大热门IO靶点,它们为B细胞成熟抗原(BCMA)、CD47、MUC1,CD20和WT1;参与研发的机构数目在两年里增加了60%;美国在全球IO研发管线中仍处于领先地位,其IO疗法占全球总数的47%,中国这一数值为16%。
2.罕见病病例要做信息登记。国家卫健委发布《关于开展罕见病病例诊疗信息登记工作的通知》及《中国罕见病诊疗服务信息系统工作管理方案》。《通知》指出,罕见病诊疗协作网成员医院应从今年11月1日开始病例信息登记工作,鼓励非协作网成员医院开展信息登记工作。2015年1月1日至今年10月31日期间诊断的病例,应在年底前登记完成;今年11月1日起新诊断病例,应当发现一例登记一例。《方案》强调,首批登记参照《第一批罕见病目录》涉及的121种罕见病。
3.浙江:上线慢病管理在线支付平台。浙江衢州市人民医院和浙江衢化医院日前已可为患者提供慢病全流程在线服务。据了解,2019年浙江省将慢病管理纳入民生实事,衢州市医保局建立了全市慢病处方流转平台,试点推行互联网诊疗、处方在线流转、医保在线支付、药品配送到家等举措,为慢病患者提供“在家复诊、在家刷医保、在家等送药上门”全新医保服务体验。下一步将逐步扩大提供在线服务的医院和药店范围。
【复星医药】控股子公司复宏汉霖及汉霖制药收到国家药监局关于同意注射用HLX55单抗用于转移性或复发性实体瘤治疗开展临床试验的通知书。复宏汉霖及汉霖制药拟于近期条件具备后于中国境内(不包括港澳台地区,下同)开展该新药的I期临床试验。
审评动向
1. CDE最新受理情况(10月17日)
暂无
2. FDA最新获批情况(北美10月16日)
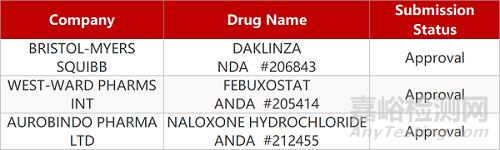

来源:药研发


