您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-09-16 09:31
2018年MDCG指南文件一览
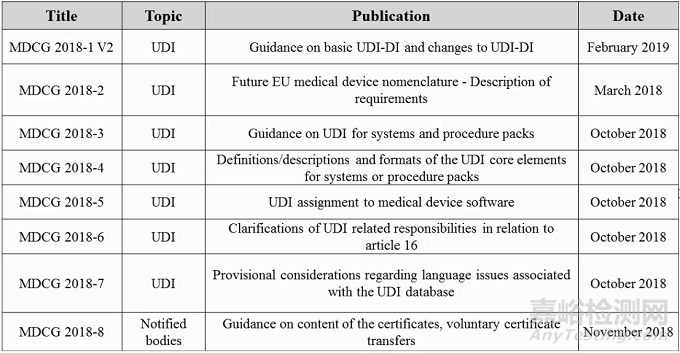
不知道大家有没有注意到,2018年这8份文件的出台时间很特别,在3月份出台了第二份指南文件后,MDCG憋了六个月,在10月和11月一口气出台了6份文件。相比之下在2019年,MDCG基本上是每个月固定颁发1-2份文件,出台节奏完全不一样。或许呢,MDCG也是渐入佳境,在有条不紊地推动新法规执行。
首先,2018-1是关于基础UDI-DI和UDI-DI变动的指南。
2018-2是关于未来欧盟医疗器械术语要求的描述,该文件对于未来术语系统要满足的要求和标准做了详细描述。因为现阶段,欧盟已经确定未来将使用CND的术语系统,那一套系统到底如何应用于医疗器械领域,与GMDN术语的匹配工作又将如何进展,我们拭目以待。
2018-3是关于系统和程序包产品的UDI指南。
2018-4是关于系统或程序包产品UDI核心数据的定义或描述及格式。
2018-5是关于医疗器械软件UDI的要求。该文件明确只有独立市售的医疗器械软件以及构成器械的软件需要符合UDI要求,并提交基础UDI-DI信息。
2018-6是对MDR和IVDR条款16中UDI相关职责的澄清。条款16是关于在什么情况下,制造商的义务适用于进口商、经销商或其他法人或自然人,其中包括UDI的职责。但是,如果经销商或进口商与制造商签订协议,标签上出现的是制造商的名字,那么是由制造商满足相关要求,包括UDI义务。
2018-7是与UDI数据库相关的语言问题的考虑。因为EUDAMED数据库最终会向公众开放,所以数据库的使用界面、器械信息应该要方便民众理解,并提供欧盟所有的官方语言。
最后一份文件2018-8是关于证书内容和证书资源转移的指南。

来源:启升资讯


