您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2019-05-07 16:32
一 、实验目的
1、测定醋酸的解离常数和解离度,加深对标准解离常数和解离度的理解;
2、测定醋酸钠的水解常数和水解度,加深对标准水解常数和水解度的理解
3、学习使用酸度计;
4、巩固移液管的基本操作,学习容量瓶的使用。
二、实验原理
醋酸(HAc)是弱电解质,在溶液中存在如下解离平衡:
HAc⇋H++Ac-
其标准解离常数Kaθ的表达式为
Kaθ= {([H+]/cθ)·([Ac-]/cθ)}/([HAc]/cθ)=([H+]·[Ac-])/[HAc] (1)
在HAc溶液中,若以c代表HAc溶液的起始浓度,则[HAc]=c-[H+],而[H+]=[Ac-],将此代入(1)则得
Kaθ= [H+]2/(c-[H+]) (2)
另外,HAc的解离度α=[H+]/c
本实验用酸度计测定已知浓度HAc溶液的pH,代入(2)、(3)即可得Kaθ和α。
醋酸钠(NaAc)是一种弱碱,在水溶液中存在如下水解平衡:
Ac-+H2O⇋HAc+OH-
其标准水解常数Khθ的表达式为
Khθ= {([HAc]/cθ)·([OH-]/cθ)}/([Ac-]/cθ)=([HAc]·[OH-])/[Ac-] (3)
在NaAc溶液中,若以c代表NaAc溶液的起始浓度,则 [NaAc]=c-[OH-],而[OH-]=[HAc],将此代入(3)则得
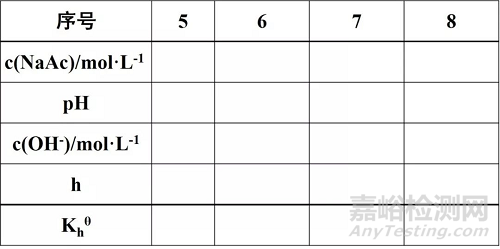
Khθ= [OH-]2/(c-[OH-]) (4)
另外,室温下[OH-]·[H+]=10-14, NaAc的水解度h=[OH-]/c
本实验用酸度计测定已知浓度NaAc溶液的pH,求出[OH-]代入(3)、(4)即可得Khθ和h。
三、实验用品
仪器:酸度计
试剂:HAc溶液(0.1mol/L), NaAc溶液(0.10mol/L)
四、实验步骤
(一)配置不同浓度醋酸和醋酸钠溶液
1.用滴定管分别吸取25.00 mL、5.00 mL、2.50 mL 0.10 mol·L-1的HAc溶液于三个50mL容量瓶中,用纯水稀释至标线,摇匀。编号为2、3、4 , 0.10 mol·L-1 HAc溶液编号为1。
2.用滴定管分别吸取25.00 mL、5.00 mL、2.50 mL 0.10 mol·L-1的NaAc溶液于三个50mL容量瓶中,用纯水稀释至标线,摇匀。编号为6、7、8 , 0.10 mol·L-1 NaAc溶液编号为5。
(二)pH值的测定
在50mL烧杯中,加入上述30mL溶液分别测定1-8号溶液的pH值并记录(测定三次取平均值),计算解离常数、解离度、水解常数和水解度。
五、实验数据记录与处理
表1 醋酸的解离常数和解离度
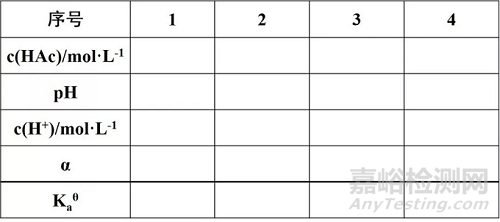
表2 醋酸钠的水解常数和水解度

来源:AnyTesting


