您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2018-08-03 12:10
欧盟医疗器械标准管理体系

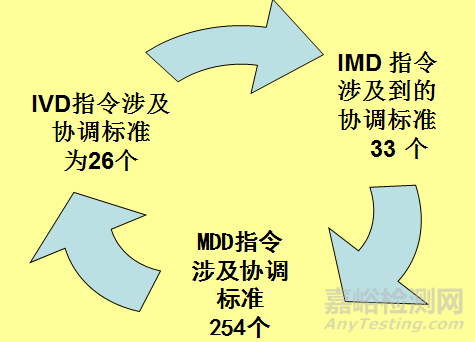
欧盟医疗器械标准管理体系由指令、符合性评估程序以及协调标准组成。根据医疗器械种类不同,欧盟在设立的医疗器械技术委员会帮助下先后制定了三个医疗器械指令有源植入性医疗器械指令(A IMD 90 /385 /EEC) 、医疗器械指令(MDD 93 /42 /EEC)、体外诊断性医疗器械指令( IVD 98 /79 /EEC) 。
有源植入性医疗器械指令(A IMD 90 /385 /EEC)
于1990年6月制定, 1993年1月1日正式实施,其后进行两次修改,修改号分别为93 /42 /EEC及93 /68 /EEC。覆盖了任何经由手术或医疗方法,全部或部分植入人体,或插入并置留于人体自然孔道中的主动式医疗器材
医疗器械指令(MDD 93 /42 /EEC)
1993年2月制定, 1995年1月1日正式实施。1998年6月13日之前为过渡期,而后数次进行修正,修正号为98 /79 / ec、2000 /70 / ec、2007 /47 /EC。该指令适用于医疗器械及其附件,是欧盟管理医疗器械产品的依据。
体外诊断性医疗器械指令( IVD 98 /79 /EEC)
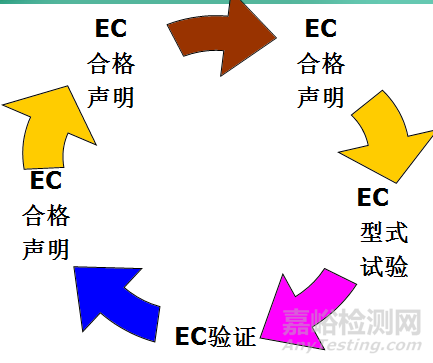
1998年10月27日发布,自公布之日起实施。该指令适用体外诊断医疗器械及其附件。MDD指令中正文第9条规定了医疗器械分为Ⅰ、Ⅱa、Ⅱb、Ⅲ四类管理。低风险性医疗器械属于I类、中度风险性医疗器械属于IIa类和IIb类;高度风险性医疗器械属于III类。MDD指令附录I中描述了医疗器械需要达到的基本要求,包括了产品的所有方面,如电磁兼容性、电气安全、性能指标,适用了所有医疗器械( I, II a, II b和III类) ,共有14项基本要求:前6项为通用要求,适用于所有的器械;后8项为设计和制造要求,可能部分适用。
医疗器械上市必须经过符合性评估程序,以证明产品满足指令的基本要求:
第Ⅰ类产品要加贴CE标志,可采取自行宣告的方式,即厂商编制产品的技术文件档案,同时自行按有关EN标准对产品进行测试或委托有能力的试验室进行测试合格。第Ⅱa类、第Ⅱb类、第Ⅲ类产品要加贴CE标志,则必须由欧盟指定的公告机构进行符合性评估。
欧盟还规定,这几类产品获得CE认证的先决条件是制造厂需能过ISO9000 +ISO13485质量体系认证,取得ISO9000 + ISO13485质量体系认证证书,且证书的颁发单位应为欧盟认可的认证机构。
MDD指令附录规定了医疗器械产品的符合性评估程序,制造商根据产品分类不同选择不同的程序。
为了便于制造商符合指令基本要求的规定,指令应借助于协调化的欧洲标准。
标准的参考信息公布于官方刊物上。符合标准既可以认为符合相应的基本要求,尽管基本要求是强制的,标准的使用仍然是自愿的。
指令规定了基本要求,详细的技术规范和定量指标则由相关协调标准规定。协调标准是欧洲标准组织欧洲标准化委员会( European Committee for Standardization, CEN) 、欧洲电工标准化委员会( EuropeanCommittee for Electrotechnical,Standardization, CENELEC)采纳的欧洲标准。
协调标准可以是CEN 和CENELEC制定的欧洲标准,也可以是其采纳的ISO与IEC发布的国际标准。
CEN与EN标准

欧洲标准委员会(CEN)成立于1961年,是非盈利的国际组织。CEN 负责制定除电子技术和通信技术之外的所有领域的欧洲标准。18个成员国负责无修改的采纳欧洲标准为本国标准。加入国鼓励使用EN标准为其国家标准,但并不强制其取缔与之相矛盾的国家标准,而且EN标准不允许被修改CEN制定欧洲标准、协调文件、欧洲预备标准以及CEN报告。欧洲标准以英文、法文和德文的方式公布。CEN和ISO在1991年签署的技术合作协议,该协议旨在尽可能最高程度等同欧洲标准和国际标准,以避免标准化工作的重复进行。非盈利国际联合组织。制定单一的电子技术协调标准,负责电子技术及电子工程领域内IEC标准没有覆盖到的地方。
CENELEC的成员以IEC成员的身份加入到IEC的工作计划之中。
双方承诺交换信息旨在协调欧洲和国家标准,作为交换,且一些CENELEC标准被采纳成为IEC标准。欧洲议会和理事会指令《关于技术标准化和法规领域制定信息规则程序》(98 /34 /EC)中对有关协调标准的制定进行了规范。98 /34 /EC指令定义欧洲标准为欧洲标准组织采纳的可以重复或者持续适用的非强制的技术规范。根据欧洲标准组织的内部规定,欧洲标准必须转化为其成员国的国家标准。协调标准虽然在制定程序及法律地位上与其他欧洲标准不尽相同,但协调标准仍然是欧洲标准的一部分,不是一项独立的欧洲标准。从标准代号( EN) 、编号方法及名称都与其他欧洲标准一致,在欧洲标准目录中也没有把协调标准单独归为一类。协调标准在新方法指令的范畴中具有法律效力,但新方法指令又规定其同其他标准一样采取自愿性的原则,制造商既可采用协调标准,也可采用其他标准或技术文件来满足新方法指令所规定的基本要求。
1. 对现行的欧洲标准进行审查确认或修订,使之满足授权书的要求;
2. 将现行国际标准或国家标准确认为协调标准;
3. 根据授权书的要求,起草新标准;
4. 欧盟委员会有时也将欧洲标准组织采用的协调文件采纳为协调标准。
1. 起草授权书,然后征求成员国的意见;
2. 将授权书传递到欧洲标准组织;
3. 欧洲标准组织接受授权书;
4. 欧洲标准组织具体制定一个(联合)程序;
5. 技术委员会制定标准草案;
6. 欧洲标准组织和国家标准机构组织公众调查和咨询;
7. 技术委员会采纳建议;
8. 国家标准机构投票/欧洲标准组织批准;
9. 欧洲标准组织向欧盟传递标准;
10. 欧盟委员会发布标准;
11. 国家标准机构转换欧洲标准;
12. 国家行政主管部门公布国家标准的编号。
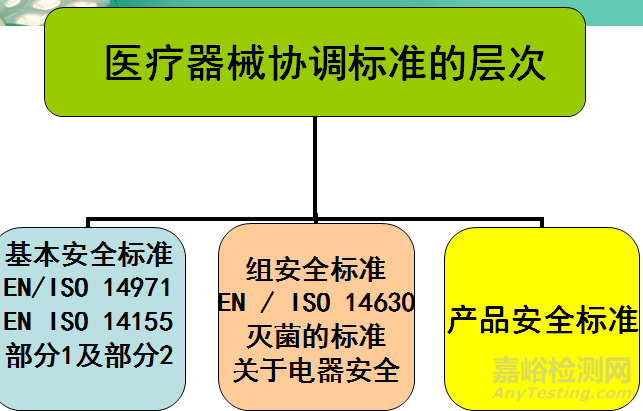
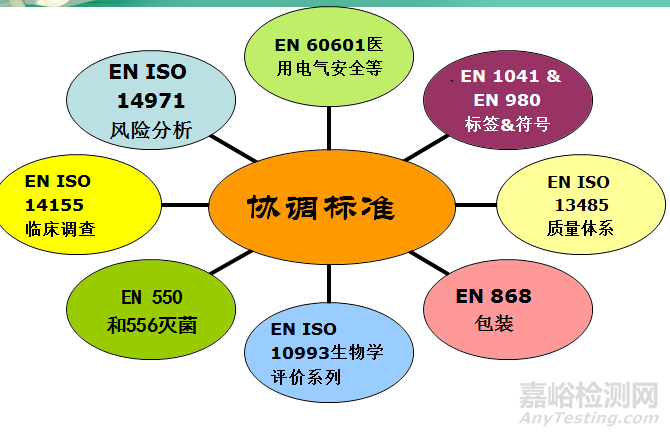
3个指令均涉及的标准包括医疗器械生物相容性标准EN ISO 10993系列、医疗器械灭菌、质量体系标准EN ISO 13485、风险分析EN ISO 14971: 2007、临床研究EN ISO 14155系列、包装等。
指令、协调标准、符合性评估程序共同构成的标准体系能够同时保证管理的稳定与技术的及时更新。

来源:嘉峪检测网


