您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2017-06-23 19:33
诺如病毒(Norovirus,NoVs),又称诺瓦克病毒,是一组形态类似、抗原略有不同的病毒颗粒。可感染人和动物引起急性肠胃炎、冬季呕吐性疾病、胃肠性流感等,主要表现为头痛、发热、恶心、腹痛腹泻等,是非细菌性胃肠炎的主要病原体之一。
诺如病毒 (norovirus,NoVs)是1972年美国学者 Kapikian在诺瓦克镇的腹泻患者粪便中首次发现并命名为诺瓦克病毒 (norwalk virus,NV),随后在第八届国际病毒命名委员会上将该病毒命名为诺如病毒。NoVs是引起人感染性胃肠炎疫情暴发和婴幼儿急性腹泻的主要病原体之一。在全世界范围内,约73%~95%的急性胃肠炎疫情暴发与NoVs有关。其中引起人类感染的主要是 GI和 GII型诺如病毒 。
据世界卫生组织统计,腹泻病造成每年5.5亿人患病和23万例死亡。儿童处于食源性腹泻病的特别危险,每年有2.2亿人患病和9.6万人死亡。诺如病毒感染性腹泻在全世界范围内均有流行,全年均可发生感染,感染对象主要是成人和学龄儿童,寒冷季节呈现高发。美国每年在所有的非细菌性腹泻暴发中,60-90%是由诺如病毒引起。荷兰、英国、日本、澳大利亚等发达国家也都有类似结果。在中国5岁以下腹泻儿童中,诺如病毒检出率为15%左右,血清抗体水平调查表明中国人群中诺如病毒的感染亦十分普遍。诺如病毒常见于牡蛎和其他贝类海产品,其抵抗力较强,在60℃高温或经快速汽蒸仍可存活。诺如病毒感染最常见的症状是腹泻、呕吐、反胃、恶心和胃痛,其他包括发热、头痛和全身酸痛等。
人类是人诺如病毒已知的唯一的宿主,患者和隐性感染者均为本病的传染源。诺如病毒是传染性很强的病毒,感染剂量为约18PFU(10-100)。诺如病毒的传播途径主要有人传人(接触)、食源性传播和水源性传播。对于食源性传播来说,主要涉及贝类、水果和坚果。
1 诺如病毒检测技术对比
食源性病毒是以食物为载体,导致人类患病的病毒。食源性病毒一直难以得到及时有效的监控,不仅对食品卫生和人民健康构成严重威胁,也对食 品工业和国民经济造成很大的影响。目前,以分子生物学技术为基础的PCR 方法成已为食源性病毒检测的主要方法。下图是不同检测技术的对比。
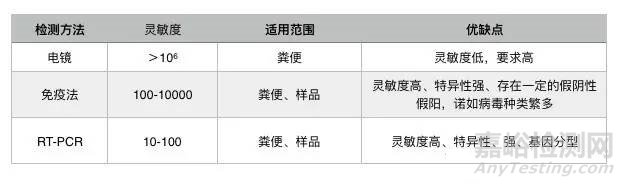
2 GB 4789.42-2016诺如病毒检测标准介绍
我国政府十分重视食品安全问题,对于诺如病毒的检测制定了非常详细的标准,名为GB 4789.42—2016食品安全国家标准 食品微生物学检验 诺如病毒检验。GB 4789.42—2016标准规定了食品中诺如病毒的实时荧光RT-PCR检测方法,此标准适用于贝类,生食蔬菜,胡萝卜、瓜、坚果等硬质表面食品,草莓、西红柿、葡萄等软质水果等食品中诺如病毒核酸的检测。
GB 4789.42—2016中对检测诺如病毒所需要的材料有着详细的限定,分别包括实时荧光PCR仪、低温冰箱、微量移液器、网状过滤袋、无菌棉拭子、无菌剪刀、无菌钳子、pH计或pH试纸、无菌刀片或等效均质器、离心机。而对于试剂,GB 4789.42—2016中注明除有特殊说明外,所有实验用试剂均为分析纯,实验用水均为无RNase超纯水。对于检测程序的要求,GB 4789.42—2016以图表的形式清晰的展现了出来。
2.1 病毒提取
标准中对样品中的诺如病毒提取明确了步骤和要求,需要注意的是过程控制病毒应该加入到样品中,如做硬质表面检测时过程控制病毒应加入棉签上,在贝类消化腺检测中应该加入到消化腺匀浆的中央,软质水果和生食蔬菜同样应该加入样品中,然后进行病毒提取。
诺如病毒的检测受到病毒的提取效率、RNA的提取效果和样品对PCR反应体系的抑制等因素的影响,而过程控制病毒的引入,可以有效的监测样品中病毒提取、RNA提取和纯化和RNA反应提取的有效性,保证结果的可靠性。目前常用的的过程控制病毒有MS2噬菌体、门果病毒和鼠诺如病毒。其中MS2噬菌体的优势为:1)国际通用过程控制病毒,在欧盟、美国广泛应用,大量文献应用MS2噬菌体做为过程控制病毒;2)结构和病毒相似,性质类似,更准确的标定;3)与其他病毒RNA无交叉;4)食品中不含有该噬菌体,无背景;5)可以实现细胞外扩增,实现精准定量;6)可同时标定回收率和扩增效率。

2.2 RNA提取和纯化
可以按照标准里手工提取,也可以使用商品化的病毒RNA提取纯化试剂盒。如选用手工提取则需要按照所需对复溶体积进行调整。如使用商品化的试剂盒则按照试剂盒操作说明操作。建议使用商品化病毒RNA提取试剂盒。RNA提取液应立即进行检测,如需长期保存建议-80℃保存。
2.3 实时荧光RT-PCR反应
可以按照GB 4789.42-2016中的引物探针及反应体系进行配置,也可以使用商品化诺如病毒核酸检测试剂盒。应提起注意的是:1)逆转录及PCR反应温度取决于反应体系中相应酶的温度,应按照说明使用;2)反应体系的体积也应按照试剂盒操作使用;3)外加扩增对照的使用,常用外加扩增对照有诺如病毒GI/GII质粒逆转录RNA、诺如病毒GⅠ/GⅡ病毒粒子提取病毒RNA、门果病毒RNA、MNV-1病毒RNA、MS2噬菌体RNA。推荐使用MS2噬菌体RNA。
3 诺如病毒检测过程—以牡蛎为例
牡蛎生长在港湾,易受流入海水的淡水污染养殖牡蛎的池塘与排污渠道相连,易受污水的污染,尤其是受到粪便排出物的污染。 牡蛎为滤食性动物,通过滤食水中微囊藻以获取食物的同时,消化道粘膜上粘多糖分子的硫酸根可与水中的诺如病毒结合并将病毒转入消化道积聚起来,成为病毒粒子的被动携带者。牡蛎消化道内诺如病毒粒子的数量可以高于周围水域几十甚至上千倍。
3.1 病毒提取
称取2g牡蛎腺体组织剪碎或者匀浆,每份样品中加入10ul MS2过程控制,加入2.0mL蛋白酶K溶液,混匀。2)恒温摇床37℃,震荡60min。60℃,水浴15min。3)3000r/min,离心5min,转移上清,测定并记录上清的mL数(V1)。
3.2 RNA提取
选用病毒 RNA 提取试剂盒,提取样品中的总RNA,需记录上样体积V2和洗脱体积V3。
3.3 MS2过程控制
取20 μL MS2 噬菌体,于95 ℃加热5 min 后在冰上冷却。按照1:9 的比例进行梯度稀释(做3 个稀释梯度),一共4 个浓度,用于制作过程控制标准曲线。
3.4反应体系配置
(1)将试剂短暂离心,按照样本数量准备足够的反应液(包括空白对照、阴性对照、过程控制和阳性对照),混匀后短暂离心,并分装,每管20 μL。如下图:
(2)设定样本孔、样本稀释孔、过程控制孔、阳性对照孔、阴性对照孔、空白对照孔,布局可参考下图:
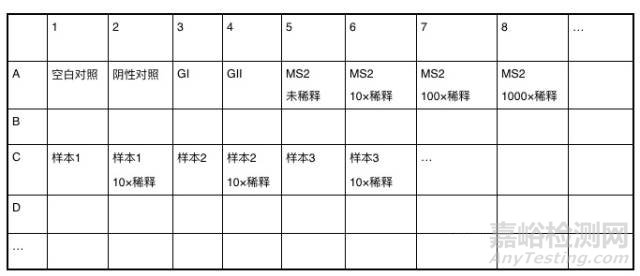
3.5 仪器设置
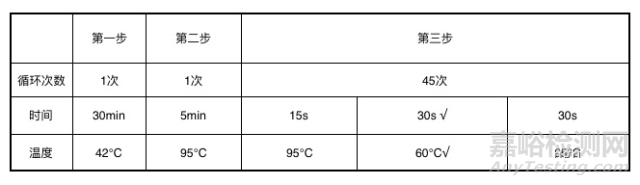
设定样本孔、 样本稀释液孔、 标准品孔(MS2)、标准品稀释液孔(3个梯度MS2)、 阳性对照孔、 阴性对照孔、 空白对照孔。通道选择: GI 检测荧光通道为 HEX, GII 检测荧光通道为 FAM, MS2检测通道为 Cy5。
3.6 上机检测
向每个诺如病毒检测 PCR 管中分别加入 5μL 模板( 包括 RNA 提取物及其 10 倍稀释液、 MS2 标准品及其稀释液、 阳性对照、 阴性对照、 空白对照);
向空白对照管中加入5 μL 空白对照;
向阴性对照管中加入5 μL 阴性对照;
向阳性对照管中分别加入5 μL 阳性对照;
向过程控制管中分别加入5 μL 过程控制及其梯度稀释;
向样本管中分别加入5 μL 样本提取液及其10 倍稀释;
盖好 PCR 管管盖, 在离心机上瞬离一下, 然后将 PCR 管放入 PCR 仪中并运行设置程序。
3.7 标准曲线绘制
MS2 的标准品效价约为 5.0x1010pfu/mL, 未稀释 RT-PCR 时的 Ct 值约为19.80±0.80。
以未稀释和梯度稀释过程控制的浓度lg 值为X 轴,以其Ct 值为Y 轴,建立过程控制标准曲线,标准曲线的R2≥0.98,斜率在-3.50~-3.10 之间。
3.8 检测有效性判定
过程控制、阳性对照没有典型的扩增曲线或者阴性对照、空白对照有扩增曲线→重新实验;
提取的RNA样本没有MS2扩增曲线→重新实验;
标准曲线R2<0.98或者斜率不在-3.50~-3.10之间→重新实验;
提取效率<1%→重新实验;
样本稀释液与样本Ct值之差<1.3→Ct值要从样本的10倍稀释管中来判断。
3.9 结果判定
HEX通道检测诺如病毒GI型,FAM通道检测诺如病毒GII型
在检测有效的情况下, HEX 通道为诺如病毒 GI 检测结果,FAM 通道为诺如病毒 GII 检测结果;
Ct≤35, 诺如病毒阳性;
35<Ct<40,建议样本重做,重做结果Ct ≥ 40,诺如病毒GI 阴性,否则为诺如病毒GI 阳性;
Ct≥40, 诺如病毒阴性。
4 Real Time RT- PCR 技术介绍
real-time RT-PCR中间的“RT”是 reverse transcription(逆转录),整个意思就是利用 mRNA 或 总RNA 为模板的实时逆转录PCR技术(quantitative Real-time RT-PCR)。real time RT-PCR指的是 qPCR+RT-PCR的组合,是说将mRNA逆转录为cDNA后再作为模板进行实时荧光PCR分析,因为RT-PCR是可以定性的,但不能进行定量检测的。real-time RT-PCR(RT-qPCR) 就是结合了荧光定量技术的反转录PCR:先从 RNA 反转录得到 cDNA(RT),然后再用 Real-time PCR进行定量分析(qPCR)。
实时荧光PCR与普通RT-PCR的区别:1)实时检测(在对数扩增期)而不是终点检测;2)灵敏度高,需要样品少;3)特异性高,精确定量; 4)在密闭的反应管中进行,无需接触EB等有害物质,减少对环境中气溶胶的污染,提高检测结果的准确性。

来源:良润生物


