您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2025-07-14 14:29
强制降解研究可能被纳入可比性评估
当生物药物生产过程发生变化时,可比性评估是必要的,以确保对药物产品的质量、安全性 和 有效性 没有不利影响。
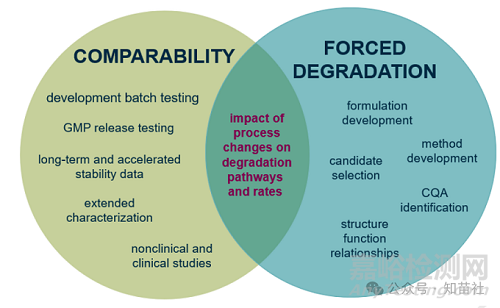
可比性
●开发批次测试
●GMP 放行测试
●长期和加速稳定性数据
●扩展表征
●非临床和临床研究
工艺变化对降解途径和速率的影响
强制降解
●制剂开发
●方法选择
●候选药物开发
●CQA 识别
●结构功能关系
强制降解研究(FDS) 对药物物质或药物产品施加应力条件,这可能超出ICH Q5C* 规定的稳定性研究中使用的条件。
ICH 专家工作组。《生物技术:生物技术/生物产品稳定性测试Q5c》。ICH 协调三方指南。1995 年。
关于可比性背景下强制降解研究的设计和解释的细节有限
ICH Q5E* 明确避免规定特定的可比性策略。
建议“为确定制造工艺变化的影响,应仔细评估产品所有可预见的后果”,以指导可比性研究的范围。
许多公司进行风险评估,这有助于指导可比性策略和范围。
●制造变化的性质
●变化影响已知产品质量属性的潜力
●可用分析技术的适用性
●开发阶段
●相关临床和非临床数据
强制降解研究的使用在ICHQ5E 中被引用:“加速和应力稳定性研究通常是建立降解谱和提供变更前和变更后产品进一步直接比较的有用工具。”
ICH 专家工作组。《生物技术/生物产品制造工艺变更后的可比性Q5e》。ICH 协调三方指南。2004 年。
行业总体实践的代表性总结
BioPhorum 发展小组强制降解工作流(BPDG-FDWS) 于2022 年进行了一项关于强制降解研究在可比性评估中使用的基准调查。
本演示文稿是BioPhorum 强制降解工作流全体成员分享意见的综合视图,不应归因于参与公司的个别立场。
每个调查问题都收到了来自至少14 家全球制药公司的回复,这些公司规模各异,产品组合多样,业务模式广泛。所有参与公司都是BPDG-FDWS 的成员,每家公司每个问题仅限一次回复。
调查重点关注:
●影响决定使用强制降解进行可比性的因素
●强制降解研究设计
●分析表征和测试策略
●数据评估标准
●强制降解在非mAb 模式中的应用
强制降解研究在可比性评估中的应用流程图
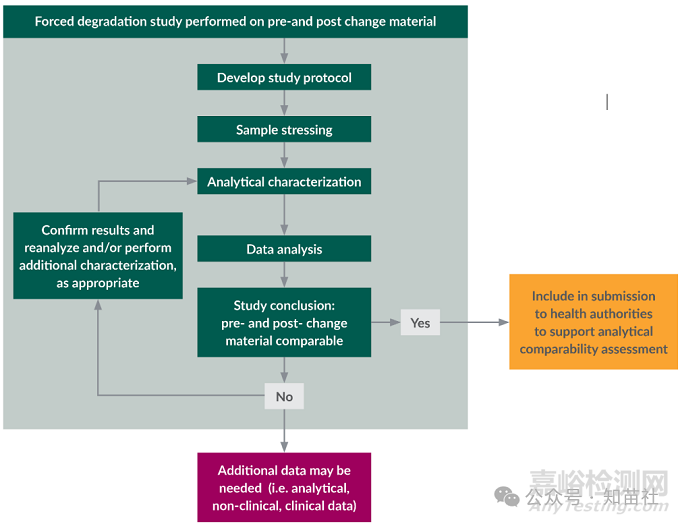
对变更前和变更后材料进行强制降解研究
1.制定研究方案
2.样品加压
3.分析表征
4.数据分析
5.研究结论:变更前和变更后材料具有可比性
○是 -> 纳入提交给卫生当局的文件中,以支持分析可比性评估。
○否 -> 可能需要额外数据(即分析、非临床、临床数据)。
6.确认结果并重新分析和/或酌情进行额外表征。
所有公司都使用强制降解研究来支持可比性。
然而,强制降解研究并非总是适用于或需要用于每项可比性研究。
影响FDS 使用的因素
连接 协作 加速™
支持可比性使用FDS 的考虑因素
●工艺变化的程度
○大多数公司使用基于风险的评估。
○风险等级决定是否需要FDS。
●发生变化的工艺步骤
○当药物物质发生变化时,产品可能需要在药物产品上进行FDS。
●产品知识量
○通常,早期项目积累的数据较少。
○商业项目需要更全面的可比性,因此产品理解更深入。
您用于可比性评估的FDS 研究在后期阶段与商业阶段相比有多全面?(19 位受访者)
公司何时使用FDS 支持可比性
●所有公司都在后期可比性阶段使用FDS。
●早期项目需求较少,因为工艺开发的机会较少。
●早期可比性评估根据具体情况进行。
●后期阶段工艺变化常见,通常需要FDS 来支持可比性。
您的公司在哪些开发阶段将FDS 应用于正式的可比性研究中?(20 位受访者)
强制降解研究设计
●FDS 研究分配
○FDS 的需求根据风险评估或其他因素确定。
●评估对CQA 的影响
○可能预期会发生什么变化?
○什么条件可能促使这种变化?
●审查先验知识
○是否有可利用的数据来消除或修改条件?
○是否存在明显的空白或需要稳健性的数据?
●应力条件
○什么条件最适合诱导目标应力?
●建立策略
○时间点
○批次
○阶段
○研究应进行多长时间以优化可比性?
○有多少批次可用?
○材料处于哪个阶段?
应力条件
●选择FDS 应力条件用于DS 或DP 研究的常见考虑因素:
○最常见的条件:温度应力(J Pharm Sci. 2020; 109(1):6-21)。
○40°C 至55°C 之间的温度主要用于诱导降解。
○单独的温度应力可能不足以诱导所有目标CQA 的变化,并且可能无法提供完整的降解模型。
○根据分子,考虑额外的应力条件,例如:光照、pH 应力、氧化应力、摇晃应力。
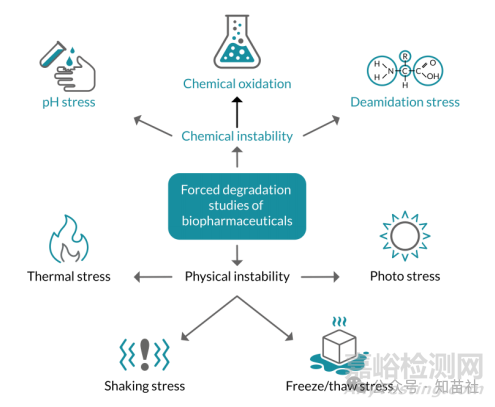
对于典型的强制降解正式可比性研究,使用了哪些强制降解条件?(18 位受访者)
应力持续时间和采样调查结果
●应力持续时间随应力选择而异。
○最常见的应力(热)持续时间通常 ≤1 个月。
○其他应力(例如pH、光和氧化应力)持续时间通常较短,≤1 周。
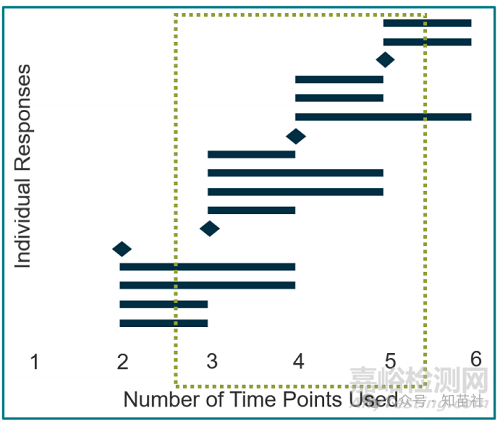
●时间点数量也随应力选择而异。
○大多数受访者倾向于使用3 到5 个时间点。
您的研究中包含多少个时间点?(17 位受访者)
批次选择
必须在变更前和变更后材料之间建立可比性。
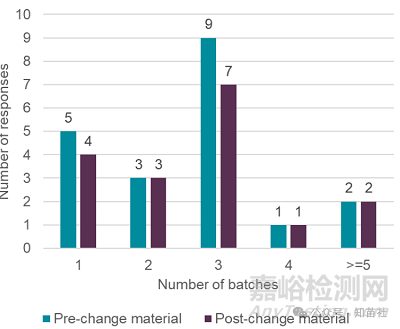
●3 个批次最常见,但并非总是可以实现。
批次选择通常受以下因素影响:
1.材料可用性
2.开发阶段
在旨在支持制造工艺可比性的强制降解研究中,通常会使用多少批次的变更前和变更后材料?请勾选所有适用项(14 位受访者)
分析表征和测试
分析表征策略的总体驱动因素
●降解途径驱动了分析表征策略中包含的检测方法的选择,用于可比性研究中的FDS。
●受访者提到的可能影响分析表征策略的其他因素包括:
○项目阶段
○工艺变化的性质
○是否影响DS 或DP
○CQA 风险评估结果对产品质量、安全性 和 有效性 潜在影响的评估
●其他考虑因素
○分析变异性
○测试效率
用于强制降解测试的分析表征
对于典型的强制降解正式可比性研究,使用哪些分析表征来评估样品?(18 位受访者)
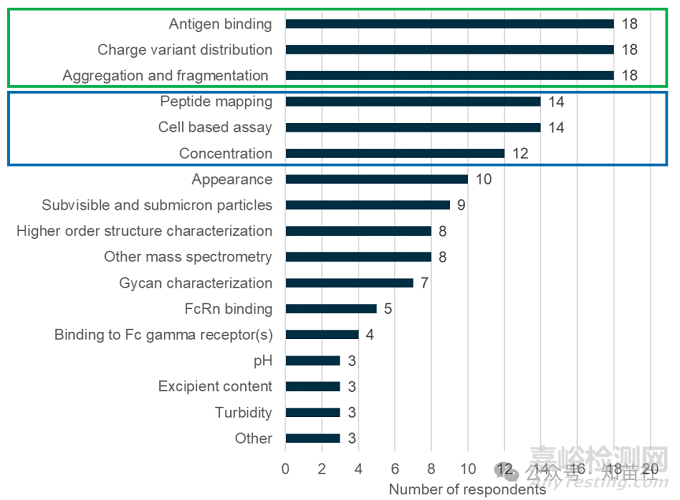
这些属性也经常被包含。
根据影响分析表征策略的因素,可能会应用其他属性。
评估标准
结果评估
●ICH Q5E 指出*:
“通常,生成变更前和变更后产品的质量数据,并进行比较……将结果与预定义标准进行比较,应能客观评估变更前和变更后产品是否具有可比性。”
●绝大多数受访者没有预定义任何定量通过/失败接受标准用于强制降解可比性结果。
●大多数受访者预定义了“评估标准”,其中包括降解途径和降解速率的比较。
*ICH 专家工作组。《生物技术/生物产品制造工艺变更后的可比性Q5e》。ICH 协调三方指南。2004 年。
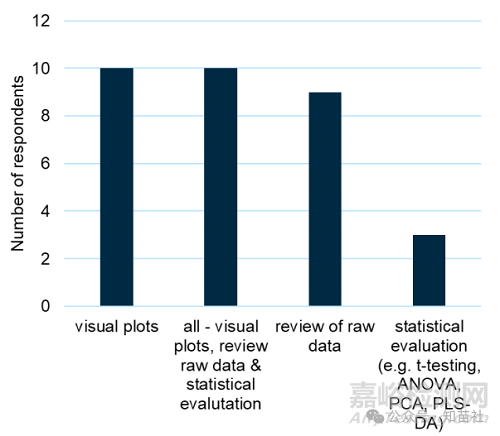
强制降解正式可比性研究如何评估?(18 位受访者)
结果评估和报告
●对分析数据集进行统计评估可以作为建立相似性的工具,但是由于数据量有限,许多可比性研究不允许进行此类评估。
●当数据集允许时,t 检验是受访者报告的一种常见策略。

●当无法完成数值统计评估时(通常如此),一般方法包括:
○速率比较(替代数值方法)
○视觉比较或图表
○定性和定量评估的组合
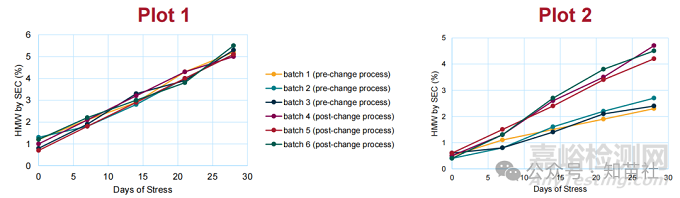
视觉图表示例和可能的结论
●假设的SEC 数据显示在下面的视觉图表中。
●图1 中显示的结果将被视为支持可比性。
●当结果未显示变更前和变更后材料之间存在任何有意义的差异时,该研究可被视为支持可比性。
●图2 中显示的结果显示变更前和变更后材料之间存在差异,可能不支持可比性。
●应进行额外评估以了解差异,确定差异是否合理,并评估其对可比性的潜在影响。
可能的结论(当FDS 中观察到差异时)
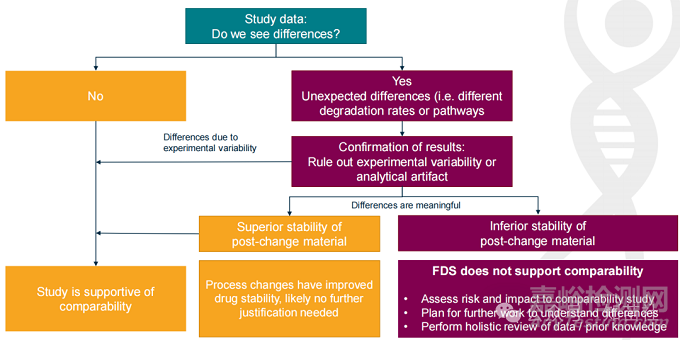
研究数据:我们是否看到差异?
●否 -> 研究支持可比性。
●是 -> 意外差异(即不同的降解速率或途径)。
○结果确认: 排除实验变异性或分析伪影。
■差异是由于实验变异性
■变更后材料稳定性更优 -> 工艺变化改善了药物稳定性,可能不需要进一步的理由。
■变更后材料稳定性较差 -> FDS 不支持可比性。
■评估风险和对可比性研究的影响。
■计划进一步工作以了解差异。
■对数据/先验知识进行整体审查。
■差异有意义
当FDS 中观察到差异时,总体可比性结论
●在确定可比性时,强制降解的结果应结合可比性研究的其他组成部分(如GMP 放行测试和扩展表征)的结果进行考虑。
●请记住(来自Q5E*):
○“可比”不意味着相同,而是“高度相似”。
○如果能确保对安全性或有效性没有不利影响,差异可能是可接受的。
*ICH 专家工作组。《生物技术/生物产品制造工艺变更后的可比性Q5e》。ICH 协调三方指南。2004 年。
非平台生物制剂模式的挑战
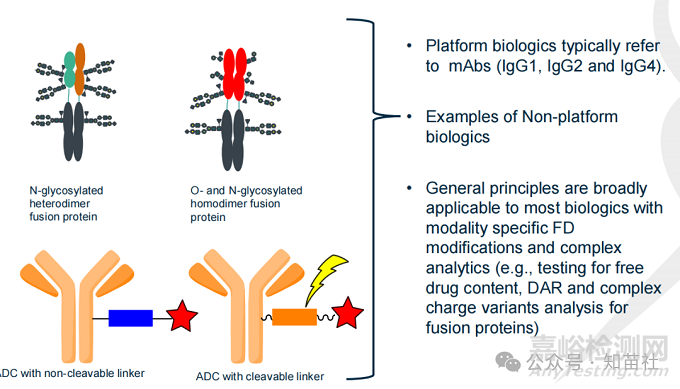
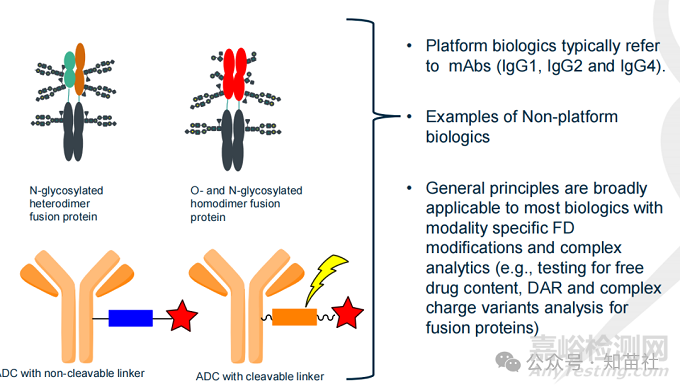
●平台生物制剂通常指mAbs (IgG1, IgG2 和IgG4)。
●非平台生物制剂的例子:
○N-糖基化异二聚体融合蛋白
○O-和N-糖基化同二聚体融合蛋白
○带不可裂解接头的ADC
○带可裂解接头的ADC
●一般原则广泛适用于大多数生物制剂,但需要根据模式进行FDS 特异性修改和复杂的分析(例如,测试游离药物含量、DAR 和融合蛋白的复杂电荷变体分析)。
非平台生物制剂模式的挑战
●通常会执行筛选研究以确定合适的应力条件。
●应力条件修改示例:
|
|
mAb |
融合蛋白 |
ADC 可裂解接头 |
|
热 |
40°-50°C 天-周* |
根据Tm 调整 天-周 |
40°C 小时 |
|
碱和酸 |
pH 8-9, pH 3-4 天* |
较温和 |
|
●总的来说,受访者承认缺乏先验知识对非平台生物制剂构成挑战。
《生物制药强制降解研究的行业视角:调查结果和建议》。J Pharm Sci. 2020; 109(1):6-21。
结论
●强制降解研究(FDS) 被所有参与调查的公司用作可比性研究的一个组成部分。
●大多数公司在制造工艺发生重大变化时使用FDS。
●大多数公司在开发的后期阶段使用FDS。
●行业调查结果旨在协助制药公司和监管机构设计和解释强制降解可比性研究。
●由于分子的多样性以及缺乏行业经验和最佳实践指南,非平台生物制剂的FDS 仍然是一个具有挑战性的过程。

来源:Internet


