安全性和有效性是新药研发的主要考虑因素。为了满足这些要求,制剂的设计旨在提供足够和可重复的药物生物利用度(BA),同时确保其在指定保质期内的物理化学稳定性。虽然分子的化学稳定性是由其化学结构决定的固有特性,但药物在药物产品中的稳定性也取决于制剂相关的特性,如其他成分(辅料)的存在、制造工艺、包装和储存条件。药物制剂旨在最大限度地提高其中所含药物的物理化学稳定性,同时确保药物的生物利用度和制剂的可制造性。对于新药的开发,药物产品的稳定性是需要持续进行研究,这不仅是因为分子结构和制剂配方变更的复杂性,同时也有助于明晰物理化学变化的机制理解,并据此制定缓解策略,奠定成功的药品开发和商业化的基础。
药物-辅料相互作用可导致固体制剂的物理和化学不稳定性。这些相互作用可能是由于药物与辅料或辅料中的反应性杂质的相互作用。在药物产品开发的早期,通过前瞻性筛选研究,如原辅料相容性研究,试图识别和避免制剂中的不稳定性。通过对这种不稳定的根本原因进行彻底的机制理解,对于减轻或最大限度地减少其发生和相关风险至关重要。
化学不稳定性是指制剂中药物分子化学结构的变化。这些变化与药物降解有关,导致药效(药物含量)降低和其他分子(降解产物或降解物)的形成。降解产物的形成是一个毒性或安全问题,而效力的降低是一个疗效问题。根据ICH指南中明确规定的每日最大允许暴露量,通过明确的检测、鉴定和毒理学界定限值,对制剂降解水平进行严格监管。
物理不稳定性是指药物产品特性的变化,不涉及药物分子结构中的化学键形成或断裂。物理不稳定性的表现为外观、药物释放、无定形体系中的结晶、多晶型、味道、气味、抗张强度、物理研磨(physical attrition)、分离(segregation)、吸附和蒸发的变化等。
今天我们重点对于制剂开发中的常见的物理稳定性问题的表现进行研究。
a.感官变化
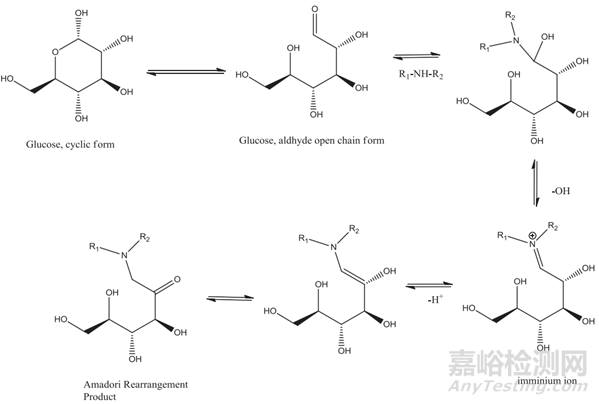
在储存过程中,外观(如表面的颜色或斑点)、味道或气味有时会发生明显变化,尤其是对于一些含有胺或磺胺基团的药物。这些变化通常与制剂的化学变化有关,如药物的降解。例如,还原糖(如乳糖)与伯胺和仲胺药物通过美拉德反应和Amadori重排的反应可以产生多种有色产物。盐酸氟西汀片可与乳糖发生美拉德反应(图1),形成有色物质。此外,一些药物,如N-乙酰半胱氨酸,可以降解为有气味的化学物质。防止感官变化的稳定策略包括通过改变配方以取代活性辅料或通过其他方式防止药物降解。
在中学课本我们学过化学变化和物理变化,两者的区别在于有无新的物质产生,而且化学变化中一定包含物理变化,物理变化中一定不包含化学变化,所以我们看到一些文献将感官变化归类到物理变化,其本质来说还是更多的因为化学变化引起来的,如有色物质产生。
图1与还原糖的仲胺药物的Amadori重排的Millard反应,导致imminium离子的形成,该离子与质子化的葡糖胺(glycosamine)平衡,或者可以去质子化形成Amadori重新排列产物(ARP)。[2]
b.药物溶出的变化
制剂的物理不稳定性也表现在药物释放或溶出的变化方面。储存期间药物释放的显著变化可能会影响其生物利用度。影响产品溶出稳定性的因素包括配方成分(活性药物、辅料和包衣材料)、加工因素、储存条件和包装。药物释放的变化通常是药物-辅料和辅料-辅料在制剂中的物理化学相互作用的结果。这些变化通常是涉及一种或多种机制变化,这些变化涉及诸如片剂孔隙率或密度的变化、原料药固态形式的变化(例如,多晶型、水合物和盐)或由于辅料相互作用而降低的崩解特性等。
众所周知,由于在高温和高湿度等应力条件(stress conditions)下的化学降解,固体制剂中游离甲醛的存在或释放会导致明胶交联并减少硬明胶胶囊的药物释放。明胶外壳的交联会导致药物释放延迟,这取决于溶出条件。延迟崩解的体内影响可能取决于治疗窗口、固有变异性和药物的特异性吸收位点。例如,Digenis等人报道了当阿莫西林用作药物标志物时,stressed and nonstressed硬明胶胶囊的生物等效性。使用放射性标记药物和使用伽马闪烁扫描研究的胃肠道转运监测,作者观察到阿莫西林吸收开始的延迟,这取决于硬明胶胶囊壳的体内破裂。然而,这种延迟吸收并不影响Cmax和AUC的生物等效性标准。
c.晶型变化
药品中药物晶型的变化通常是通过其对一个或多个药品性能属性的影响来检测的,例如使用区分力方法的药物释放或溶出。例如,在片剂配方中,可以使用区别溶出法检测药物格列美脲的高溶解度II型向低溶解度I型的显著转化,以及从亚稳定型向稳定型的过渡。药物多晶型的变化可以使用XRD;红外(IR)、近红外(NIR)、固态核磁共振(ss-NMR)或拉曼光谱;溶剂吸附等温线;偏光显微镜;和热台显微镜等。
药物晶型的变化可能是药物与制剂的另一种成分(如辅料或水)相互作用的结果。例如,用胶体二氧化硅研磨导致结晶度降低,乙酸氯霉素的晶型B转化为晶型A。用研磨辅料研磨导致结晶度降低,这表明
水对药物晶型转化的影响通常在药物产品储存过程中观察到,但也可能发生在加工过程中。制剂的水分含量对其储存稳定性的影响是药物产品的游离水含量而非总水含量的函数。因此,水敏药物的薄膜包衣片剂与具有高总水含量(通过Karl Fisher滴定法)但低水活性的制剂相比,在低总水含量但高水活性下表现出更大的不稳定性。类似地,将药物产品储存在游离水的临界水平以上可以导致化合物的不同水合物晶型之间的转化。例如,呋喃妥因以两种无水形式(指定为α和β)和两种单水形式(指定的I和II)存在。高湿度储存和加工条件,例如湿法制粒,可能导致无水物转化为一水合物形式,这可以通过PXRD光谱中出现特定峰来检测,该峰指示一水合物形式的存在。辅料相互作用也可用于稳定药物以防止形式转化。例如,在湿法制粒过程中,茶碱从亚稳定到稳定的形式转变受到PVP的抑制。较高分子量的聚维酮在抑制转变方面比较低分子量的更有效。
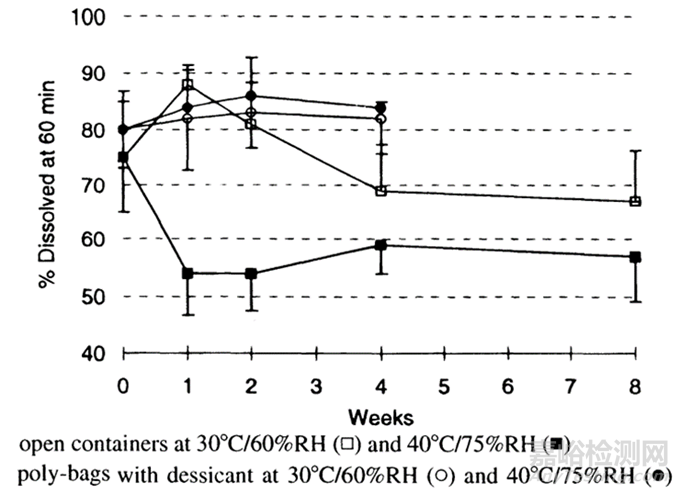
图2 甲磺酸地拉韦啶200mg规格片剂溶出稳定性[4]
由于吸湿和/或与制剂中辅料的相互作用,弱碱盐的歧化,可导致游离碱形式的形成或比例增加,其通常表现出较低的溶解度、溶出速率和生物利用度。例如,Rohrs等人报道了甲磺酸地拉韦啶片剂在稳定性方面的溶出减慢,这与片剂的水分含量密切相关。这归因于药物的游离碱形式的溶解度降低和甲磺酸对交联羧甲基纤维素钠上羧基位点的质子化(通过药物的分散释放)的双重作用。药物的盐形式的歧化倾向取决于盐的溶解度、游离碱的溶解度以及相对于盐的最大溶解度的pH(pHmax)的制剂的微环境pH。
总之,新药开发是一个系统且宏大的工程,对于药物人员来说要明确药物开发的目标与宗旨-制备安全性,有效性,稳定性,可控的药物产品。随着对于制剂的要求是药物产品的生物利用度,稳定性和可生产性,三者缺一不可。研发过程中,遇到不少的同事,致力于实现某种目标而忽略了其他的质量标准,最终也是无法得到符合标准的产品,仅仅是达到了某种诉求。本文简单介绍了稳定性中的物理稳定性,其中也牵涉到了不少的化学反应。稍后有机会我们会花更多的精力介绍化学稳定性,因为化学稳定性更加的复杂,涉及各种辅料以及各种反应机理。
参考文献
1.Maillard Reaction of Lactose and Fluoxetine Hydrochloride, a Secondary Amine
2.Impact of Excipient Interactions on Solid Dosage Form Stability
3.Bioequivalence Study of Stressed and Nonstressed Hard Gelatin Capsules Using Amoxicillin as a Drug Marker and Gamma Scintigraphy to Confirm Time and GI Location of In Vivo Capsule Rupture
4.Tablet Dissolution Affected by a Moisture Mediated Solid-State Interaction Between Drug and Disintegrant