今日头条
映恩妇科ADC拟纳入突破性品种。映恩生物与BioNTech公司合作开发的HER2 ADC药物DB-1303(BNT323)获CDE拟纳入突破性治疗品种,拟用于治疗既往免疫检查点抑制剂(ICI)治疗期间或治疗后进展的晚期、复发性或转移性HER2表达子宫内膜癌。在Ⅰ/Ⅱ期临床中,DB-1303未经确认的客观缓解率(ORR)和疾病控制率(DCR)分别为58.8%和94.1%。此前FDA已授予DB-1303针对子宫内膜癌的突破性疗法认定和快速通道资格。
国内药讯
1.葆元/信达肺癌新药报新NDA。信达生物与葆元医药开发的新一代ROS1/NTRK抑制剂己二酸他雷替尼胶囊(DS-6051,泰莱替尼)的第二项上市申请获CDE受理,用于一线治疗未经ROS1 TKI治疗的局部晚期或转移性ROS1阳性非小细胞肺癌(NSCLC)。值得一提的是,该药用于治疗经ROS1-TKI治疗失败的ROS1阳性局部晚期或转移性NSCLC患者的首个NDA正接受CDE优先审评。
2.君实PD-1鼻咽癌Ⅱ期临床见刊。君实生物PD-1单抗特瑞普利单抗联合卡培他滨治疗残留鼻咽癌患者的Ⅱ期临床积极结果已发表于《自然-通讯》期刊上。结果显示:特瑞普利单抗联合卡培他滨治疗6周期,客观缓解率(ORR)达到95.7%,疾病控制率(DCR)为100%;12个月及24个月的无进展生存期(PFS)率分别为95.7%和82.4%。此外,特瑞普利单抗联合用药耐受性良好。
3. 信达哮喘新药启动澳洲临床。信达生物IL-4Rα/TSLP双抗IBI3002在澳大利亚启动首次人体(FIH)I期临床(NCT06213844),拟评估IBI3002在健康受试者和轻中度哮喘受试者中的安全性、耐受性、药代动力学(PK)以及治疗中重度哮喘的初步疗效。BI3002具有高效的IL-4Rα和TSLP共同阻断功能,有望为包括哮喘在内的炎症性疾病患者提供新的治疗选择。
4.复星NK细胞疗法获批IND。复星医药旗下精缮生物1类新药“GCK-01细胞注射液”获国家药监局临床许可,拟开发治疗复发或难治性滤泡性淋巴瘤(FL)。GCK-01是一款同源异体外周血来源的现货型NK细胞疗法,以CD20为靶点,通过改造NK细胞的功能,使其能够更高效地识别和攻击肿瘤细胞。此前,研究者发起了一项临床试验,评估GCK-01治疗复发或难治性B细胞非霍奇金淋巴瘤患者的效果。
5.成都先导引进降脂新药获批IND。成都先导旗下公司成都先衍生物引进的1类化药A24110He注射液(Lipisense®)临床试验申请(IND)获CDE批准,拟开发用于治疗严重高甘油三酯血症。Lipisense®是瑞典Lipigon公司开发的一款靶向ANGPTL4的反义核酸(ASO)药物,旨在长效降低甘油三酯的同时改善胰岛素抵抗,有望为血脂异常或严重高甘油三酯血症患者提供新的治疗选择。先衍生物拥有A24110He的大中华区权益。
6.复宏汉霖2023年扭亏为盈。复宏汉霖发布正面盈利预告,2023年度未经审核的年内利润不低于5亿元,2022年则为亏损6.95亿元,这也是复宏汉霖在2023年上半年首次实现半年度盈利之后,首次实现全年度盈利。从此前三季报的数据来看,前三季度总收入39.3亿元,产品收入33.8亿元,其中汉曲优(曲妥珠单抗)9个月大卖20.14亿元,汉斯状(斯鲁利单抗)大卖8.65亿元,汉利康(利妥昔单抗)销售额3.85亿元。
国际药讯
1.Hugel公司医美肉毒素获批上市。Hugel America公司A型肉毒素Letybo(letibotulinumtoxinA)获FDA批准,用于治疗成人中度至重度眉间纹。Letybo是一种乙酰胆碱释放抑制剂和神经肌肉阻滞剂,通过肌肉内注射,可改善与皱眉肌/降眉肌活动相关的中重度眉间纹外观。在Ⅲ期试验中,与安慰剂相比,Letybo治疗第4周时患者的眉间纹改善获得0或1分、且在最大皱眉时较基线改善至少2分的受试者比例更高。
2.AZ/第一三共ADC欧盟报新NDA。阿斯利康与第一三共开发的靶向TROP2的ADC药物Dato-DXd(Datopotamab deruxtecan)的两项上市许可申请(MAAs)获欧盟EMA受理,用于治疗局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)经治患者;以及用于治疗不适合内分泌治疗的转移性HR阳性、HER2低表达或阴性(IHC 0、IHC 1+或IHC 2+/ISH-)乳腺癌经治患者。此次申请MAAs是基于关键III期TROPION-Lung01研究以及TROPION-Breast01研究的积极数据。
3.SpringWorks公司罕见病新药报NDA。SpringWorks公司MEK抑制剂mirdametinib已启动向FDA滚动递交新药申请(NDA),用于治疗儿童和成人神经纤维瘤病1型相关的丛状神经纤维瘤(NF1-PN)。在Ⅱb期ReNeu试验中,经盲态独立中心(blinded independent central review,BICR)评估,mirdametinib在儿童和成人患者中获得确认的客观缓解率分别为52%和41%;靶肿瘤体积分别缩小42%和41%。此前,FDA和欧盟EMA均授予mirdametinib治疗NF1的孤儿药资格。
4.Avidity公司AOCs药物将上Ⅲ期临床。Avidity Biosciences公司抗体偶联寡核苷酸(AOCs)药物del-desiran(AOC 1001)治疗1型强直性肌营养不良(DM1)的扩展研究(MARINA-OLE)结果积极。与自然病史研究人群相比,AOC 1001治疗一年期间可在多个临床终点上逆转疾病进展,包括肌张力、肌肉力量和患者报告的日常生活活动;且药物长期耐受性良好,所有相关不良事件(AE)均为轻中度。该公司计划尽快启动Ⅲ期临床HARBOR。
5.Akero公司MASH新药长期疗效积极。Akero公司FGF21类似物efruxifermin (EFX) 治疗肝硬化前代谢功能障碍相关脂肪性肝炎(MASH)的IIb期研究结果积极。在第96周时,与安慰剂相比,Efruxifermin(50mg和28mg)治疗组达到的缓解的患者比例更高(75%vs24%,p<0.001;46%vs24%,p=0.07);有更多患者达到2级纤维化改善且MASH没有恶化(36%和31%,vs3%)。目前,该新药正在III期SYNCHRONY研究中评估用于代偿性肝硬化(F4)MASH的治疗效果。
6.默克联手C4T开发新型蛋白降解剂。德国默克与C4 Therapeutics(C4T)公司将利用后者专有TORPEDO技术平台,针对默克所选的两个关键致癌蛋白,合作开发新型蛋白降解剂。根据协议,C4T将获得1600万美元的前期付款,可能高达7.4亿美元的药物发现、监管和商业里程碑后期付款。德国默克将负责合作候选药物的临床开发和商业化。
医药热点
1.人大代表建议制定“心血管健康促进法”。3月5日,在全国两会上,第十四届全国人大代表、华中科技大学同济医学院附属同济医院内科学系名誉主任汪道文教授就加强心血管健康管理提出制定“心血管健康促进法”的建议。他希望通过立法手段,提升心血管疾病的预防和控制能力,推动医防协同,并将心血管疾病的预防工作纳入基层组织的行政管理考核体系,以全面提升国民心血管健康水平。
2.上海拟建设数字健康城区和未来医院。2024年上海市卫生健康工作会议于2月28日召开,围绕医疗资源配置,提出了今年一系列建设目标:推进各类国家级试点,优化公立医院绩效考核指标体系;力争新增1-2家国家医学中心和一批国家临床重点专科;建设30家护理中心、15家示范性康复中心和50家开展中医药巡诊服务的社区卫生服务站点等。此外,推进数字化转型,促进互联网医院发展,建设数字健康城区和未来医院,开展区块链创新应用试点。
3.韩国:未复岗医生执照将被吊销至少3个月。韩国保健福祉部第二次官朴敏守当地时间3月4日上午在记者会上宣布,计划对医生集体辞职离岗行动核心负责人采取严厉措施。韩国政府将现场检查医生的出勤情况,如果相关实习和住院医生违反政府的复岗命令,将受到3个月吊销医师执照的处分。另外,相关行政处分履历及其理由将会被记录下来,或对今后就业产生不利影响。
评审动态
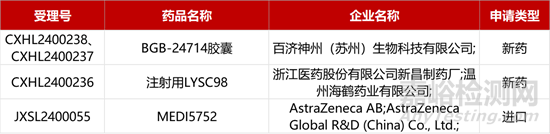
1. CDE新药受理情况(03月05)
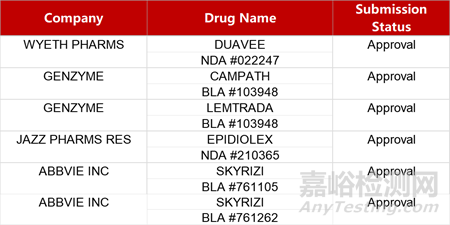
2. FDA新药获批情况(北美03月04日)