在2022年11月,由RDPAC 的药学团队对中美欧药学技术指导原则和指南进行了调研与对比,总结分析了中美欧指南的标准差异及实施情况差异,采用了主题词及分类方式、深度对比、报告撰写和定稿流程,最后呈现研究报告,给到药审中心参考。
课题组对我国已有的药学技术指导原则(以下简称指南),FDA 和 EMA 官网上公布的药学部分指南进行梳理,共对 75 个中国的药学技术指导原则、187 个 FDA 指导原则和 76 个 EMA 指导原则进行比对,并对欧美有,我国是否有进行分类。具体数量如表格 1 所示。
总体特点:
通过对指南中的关键词来对比各国指导原则后,课题组发现我国的药学部分的一个指南中常常参考或引用了其他多个国家或多个指导原则,虽然数量上差距较大,但内容上有重叠;而欧美的指南相对比较细化,也是专题讨论为主,数量就会比较多。
为此,很难简单的通过对比指南的数量来判断我国的药学部分指南是否存在差异,更适合以问题为导向,采用指导原则的制定及引导来解决问题。
课题组在 2022 年 6 月发起了第一次行业调研,共收集 12 家行业代表企业的反馈,这些企业均有境外及境内业务,涉及 86 项相关行业问题,41 个需要通过新制定相关文件来解决,76 个与目前已有的部分指导原则相关,还有部分与目前的指导原则是否仍旧有效相关。基于这些问题,课题组开展了深度访谈,了解其背后的原因,以及国际上管理模式的差别。基于本次调研,课题组与 2022 年 10 月与药审中心药学专业部门开展沟通交流,反馈推荐制定指南的清单及推荐理由。
结合药学专业部门建议,以收集本土企业的研发问题为目标,课题组在 2022 年 11 月通过问卷调研进行了问题收集。本次调研共有 119 个产业代表提供反馈,其中国内企业代表 97 位, 占比 81%,可反映我国制药企业的核心诉求。基于如上两次调研的结果,课题组推荐药学相关推荐制定、修订的指南清单。
对比结论
我国已形成初具规模的药学指导原则体系。
我国药学研究发展历史较长,近年来工业现代化进程明显,同时中国创新药研发以及跨国同步申报情况增多,药学研究基础日渐成熟。
在 NMPA 加入 ICH 之前,我国就开展了药学相关技术指导原则(以下简称指南)的制定工作, 加入 ICH 之后,伴随 ICH 各项药学相关指导原则的实施,以及近期药审中心连续发布的系列药学相关技术指导原则,从整体上构建了创新药药学研究指南体系。这一体系包括创新药原料药、制剂研究指南,热点领域(如细胞基因治疗等)的药学研究指南,临床期间药学变更及上 市后药学变更指南,仿制药及生物类似药药学指南等等,与 EMA 及 FDA 的技术要求相似,为行业研发提供了重要的参考依据。
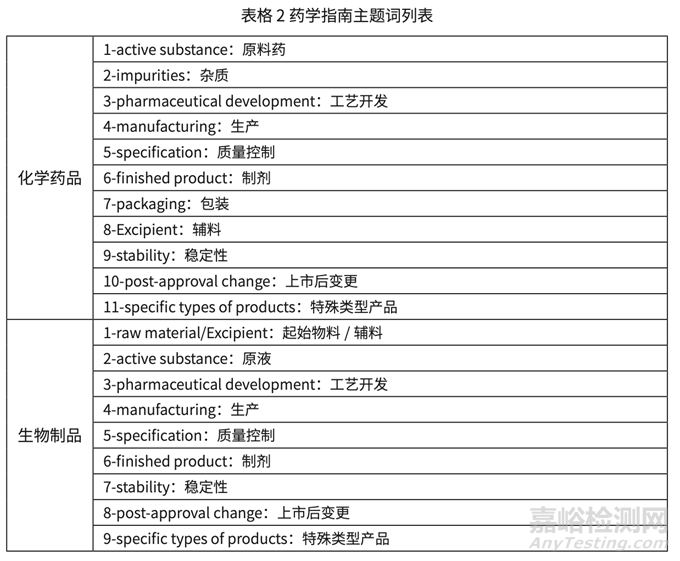
课题组对我国已有的药学技术指导原则(以下简称指南),FDA 和 EMA 官网上公布的药 学部分指南进行梳理。目前我国药学指南尚未分类,课题组部分的参考了 EMA 的分类方法, 结合当前研发实践的需要,推荐按照如下的主题词对我国药学指南进行分类,以方便行业查找和学习,具体结果如下表格 2 所示。
特别说明
1、各个国家制定技术指导原则的前提均有所不同,需要基于管理模式、行业相状、教育水平等等综合考虑。而 2022 年 11 月的调研以收集国内研发问题为目的,这些问题不一定与境内外的技术指导原则存在差异相关,所推荐的指南未必与境外指南存在差异,或境外有类似指南可以作为制定的参考。
2、药学专业要求及管理模式上,我国与欧盟、美国存在不同。例如欧盟以上市持有人及质量负责人(QP)制度为基础,通过主体责任深度落实的管理手段,弱化了药品检验相关的要求; 美国以核查管理为支持,通过加强现场检查的管理手段,放宽了对部分工艺验证性研究结果递交时限等此类要求,但在包括跨境现场检查时对其研究结果进行确认;此外,基于各国工业界 的现状,药典检测项目的方法学和限度要求也存在差异。为此,当前我国行业对药学研究部分反馈的某些问题,包括检验、工艺验证及药典协调等问题,无法通过技术指导原则的统一进行解决。
3、课题组也对加入 ICH 前,我国制定的药学部分指南进行了梳理,推荐对部分指南进行明文废止,或者中心对不再适用的指导原则,明确新老版本,并对社会明确以最新版本为准。
4、在未来,课题组推荐扩大研究团队,纳入更多的本土代表企业以推进相关领域的问题收集、纳入辅料包材企业或行业协会,调研对欧美日监管机构对于辅料和包材的审评技术要求, 以推荐后续我国技术审评部门考虑如何设计及推进相关技术指南的制定及修订计划。
学习小结:
1. 国内的药学指南主题数量目前有限,还处在上升发展阶段,相对于美国和欧盟,还不够成熟,我国加入ICH时间相对不长。欧美药学指南体系发展是在ICH指南之前已经有很长一段时间了。
2. 国内药学指南的主题不够专注,一篇指南常会包含多个欧美指南的内容。
3. 创新药和热点领域的指南相对于仿制药更稀缺,这方面的发展潜力很大,ICH指南的采纳实施会越来越多。
4.国内药学的监管与欧美有差异有相同点:美国强调现场的检查,欧盟强调MAH和QP制度,国内三位一体,审评,检验和核查。
5.国内对于辅包的技术审评指南还较少,有较大的提升空间。
6. 参考EMA的指南分类方式,调研以主题词为线索,11个化学主题词和9个生物制品主题词,逐步展开。国内以主题词分类指南的体系暂未建立
参考文献
1.国内外药品技术指导原则体系对比研究 (药学部分》,国家药品监督管理局药品审评中心,中国药品监督管理研究会,药品监管研究国际交流专业委员会,中国外商投资企业协会药品研制和开发工作委员会(RDPAC),2022年11月