心血管器械中的摩擦学问题根据摩擦性质的不同可分为3类:
心血管设备中的运动部件产生的机械磨损和摩擦
血流在各种心血管设备的表面产生的流体摩擦;
在植入或原位正常功能过程中,装置与人体软组织之间发生的摩擦;
其中,血流在植介入体表面形成的流体摩擦会触发异常的凝血机制,从而形成血栓,这给心血管植入器械的设计和应用带来巨大的挑战。
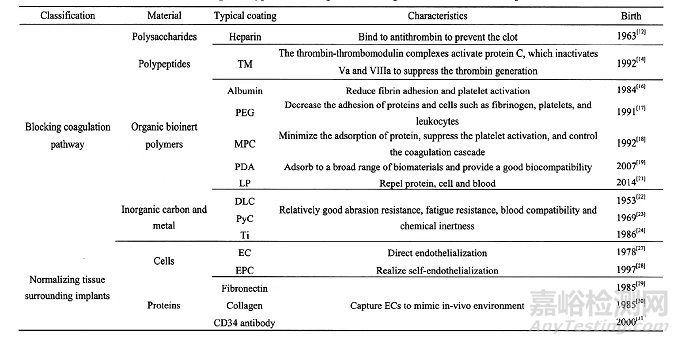
根据植介入体表面与血液接触的异常凝血机理,其抗凝路线可分为阻断凝血路径和实现介入器械周围组织正常化两类。
1、阻断凝血路径
阻断凝血路径主要包括药物涂层和生物惰性涂层,其中药物涂层是将活性抗凝药物固定在植介入体表面上,调节凝血和补体系统,并减少进一步的炎症反应;生物惰性涂层通过减少植介入体表面和血液成分之间的相互作用来抑制血液活化。而植介入器械周围组织正常化通过模拟天然细胞内皮的表面来实现抗凝。
抗凝药物涂层主要包括肝素、血栓调节素和水蛭素等。
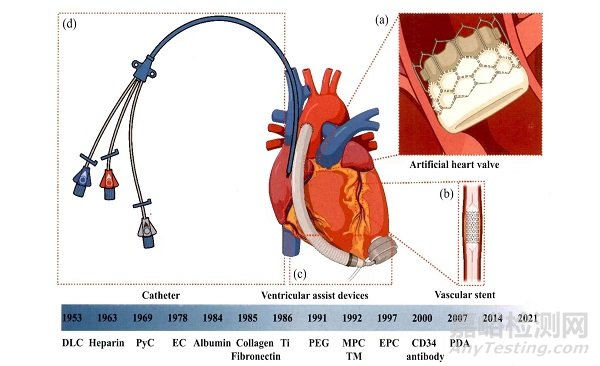
其中,肝素是目前最重要的抗凝药物之一。肝素于1963年首次作为涂层被应用于人工心脏瓣膜,现在己广泛应用于商业心血管植介入体.肝素的五糖序列可以与抗凝血酶结合,从而改变抗凝血酶的构象,并将抗凝血酶介导的各种丝氨酸蛋白酶凝血因子的抑制率提高100~1000倍.在相关文献中可以找到关于医用肝素涂层的详细论述。血栓调节素(Thrombo modulin,TM)是一种由内皮细胞(Endothelial cell,EC)表达的跨膜蛋白,于1992年首次应用,其原理是通过凝血酶。血栓调节蛋白复合物激活蛋白C,激活的蛋白C使凝血因子Va和VIIIa失活,从而抑制凝血酶的产生。
生物惰性涂层包括有机惰性涂层和无机惰性涂层。
作为血液中最为丰富的蛋白质,白蛋白自1984年以来,己被广泛用于减少纤维蛋白黏附和减少聚乙烯材料上的血小板激活。
另一种有机聚合物,聚乙二醇(P01yethylene 91ycol,PEG),于1991年开始应用。
PEG通过“接枝”的方法共价连接到表面,形成线性聚合物刷,进而排斥蛋白质吸附,1991年以来,两性离子,如2.甲基丙烯酰氧乙基磷酰胆碱(Methacryloylox yethylphosphorylcholine,MPC)也被开发出来,其具有减少补体激活和蛋白质黏附效果。这类涂层最突出的特点是显著减少蛋白质黏附和血小板活化。
此外,尽管聚多巴胺(P01ydopamine,PDA)不直接参与抗凝,但其可以自发吸附到不同的表面上,并为涂层材料提供优异的生物相容性。随后,受猪笼草的启发,有研究者在2011年开发了润滑、注入液体和多孔表面(SLIPS)的概念。在针对血液的SLIPS技术中,通过将平滑且无缺陷的液体全氟化碳(Liquid perfluorocarbons,LP)固定在植介入体表面,涂层可以实现排斥血液中的蛋白和血小板的功能,并具有自修复能力。
无机生物惰性涂层的材料主要包括类金刚石(DLC)、热解炭(PyC)和钛等。DLC是无定形碳的亚稳态形式,该材料于1953年被研制出来,并在1971年首次被命名为DLC。由于DLC的疏水性和表面光滑性,已广泛应用于心室辅助装置。另一种碳基涂层PyC是一种由碳氢化合物气体热解形成的合成材料,自1969年以来已成为机械心脏瓣膜上最受欢迎的涂层,这些无机涂层一般具有较好生物相容性和优异的物理性能。
2、实现植介入体周围组织正常化
实现植介入体周围组织正常化一般通过模拟血管壁表层的天然构造或功能以实现优异的血液相容性。
如将EC预先接种在植介入体表面,可以有效降低植介入体血栓形成和新生内膜纤维增生。这种方法于1978年被首次报道。此外,1997年发现的内皮祖细胞(Endothelial progenitor cell,EPC),可以快速实现自我内皮化。然而,直接固定EC十分复杂。因此,纤连蛋白和胶原蛋白等细胞外基质蛋白以及能够在体内捕获EC的抗体或特异性生长因子,如CD34抗体也得到广泛应用。此外,TiO2涂层也可以用来诱导(引导)内皮细胞黏附及增殖。
*心血管植介入体和抗凝涂层的历史:(a)人工心脏瓣膜;(b)血管支架;(c)心室辅助装置;(d)导管。
图片来源:医休神介说
1-血管植介入体上典型抗凝涂层的原理
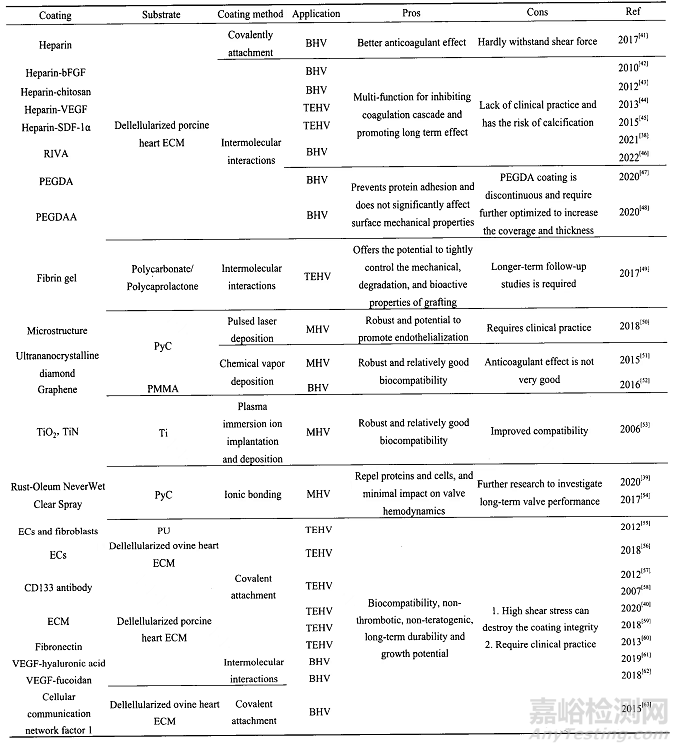
2-人工心脏瓣膜的抗凝涂层
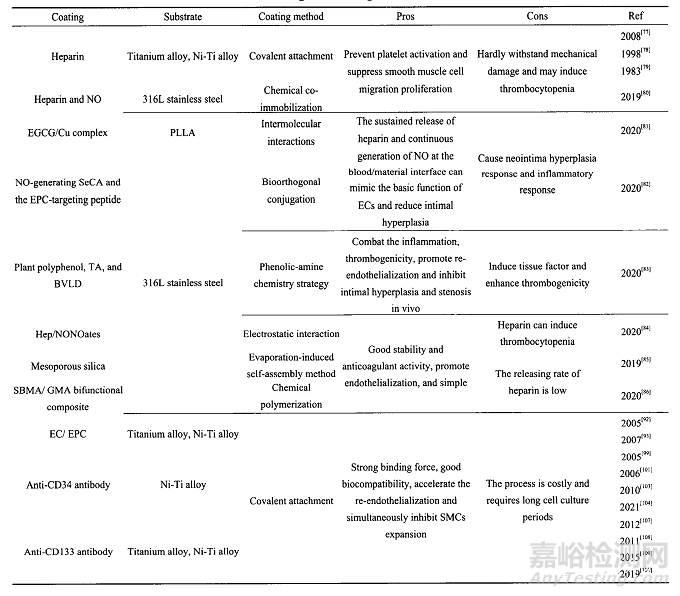
3-血管支架上的抗凝涂层
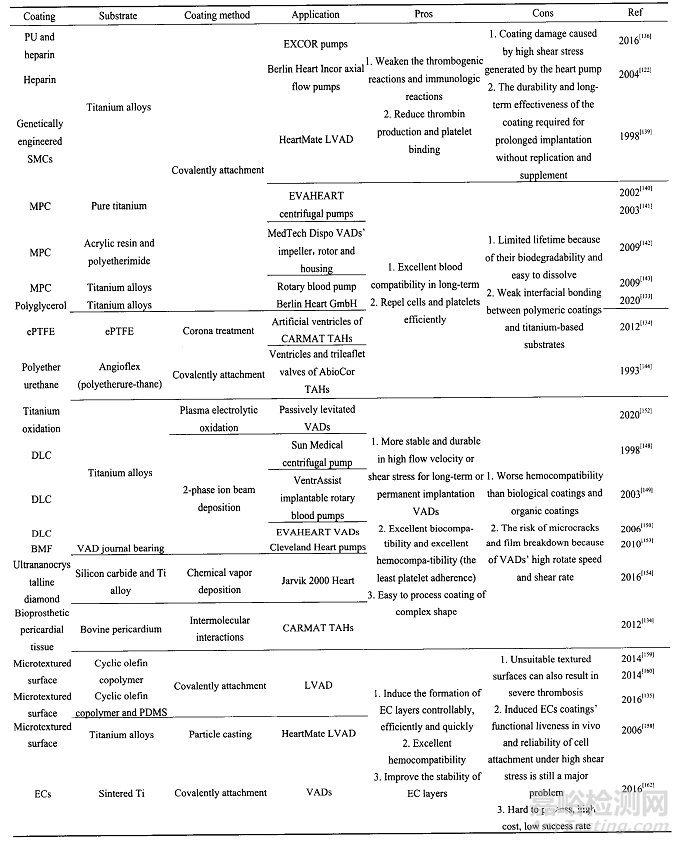
4-心室辅助装置抗凝涂层
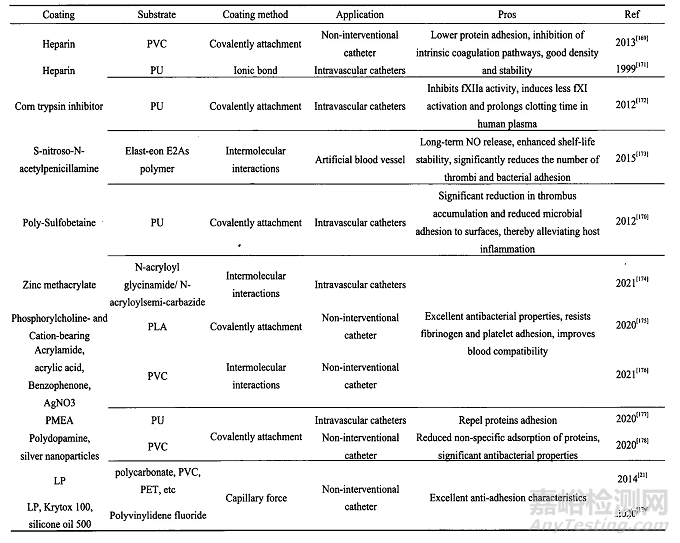
5-导管表面抗凝涂层