抗体药物研发、申报和生产过程均伴随着对产品的质量研究和质量控制。抗体药物质量分析涉及多个方面,欧洲药品管理局(EMA)和国际协调会议(ICH)指南Q6B[1,2]都要求对抗体药物进行表征,从理化、结构性质和杂质等方面进行广泛而全面的质量属性表征研究,为生物技术产品的表征提供了一套统一的国际公认原则,以支持抗体药物的市场应用。抗体药物的结构表征通常包括以下几个方面,见表1。
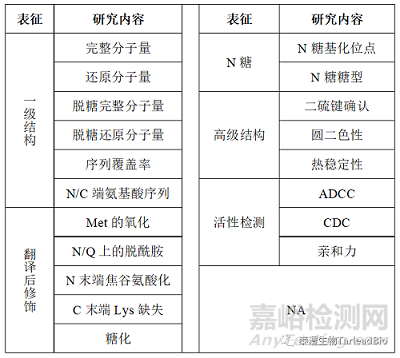
表1 表征研究内容
1. 一级结构
1.1. 分子量
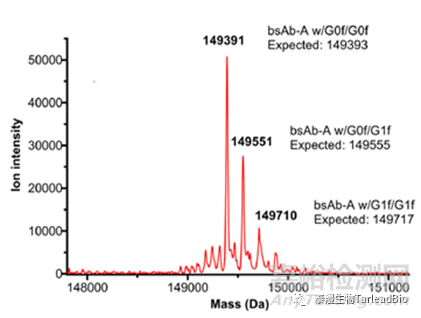
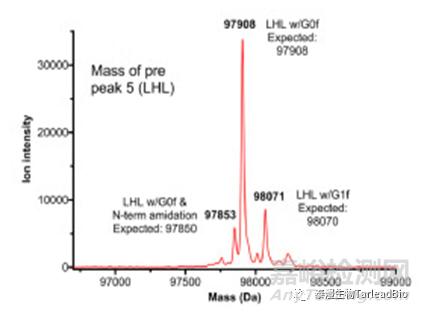
分子量分为完整分子量和还原分子量分子量,从整体来表征抗体分子,确认抗体分子是否有片段缺失、错配(图1)。对于双抗或其他多抗,目的分子和错配分子(如同源二聚体)之间的分子量相差不大,小到相差十几个Da,理化性质差别小,用常规的色谱方法无法区分双抗的错配情况,需要用液相色谱-串联质谱(LC-MS/MS)检测出的精确分子量来检测错配比例,指导早期CMC工艺的开发。此外,还可以用特异的N/O糖酶(PNGase F和O-糖酶)切掉抗体上的N/O糖,消除糖型对分子量检测的影响,从而可以更准确的表征抗体分子特性。
图1 双抗样本的分子量[3]
上:目的分子的完整分子量;下:错配类型(LHL型)的分子量
1.2. 氨基酸序列覆盖率与N/C端序列确认
除了分子量,还需要用肽图来表征目的分子的氨基酸序列。样本经变性还原和烷基化后,加特异性酶酶切,经LC-MS检测分析,与理论序列比对,得到抗体的序列覆盖率。常用的酶有胰蛋白酶(trypsin)、Glu-C和糜蛋白酶(chymotrypsin)等,根据各酶的特异性酶切位点选择合适的酶(表2)。结合多种酶切结果,可以达到100%的序列覆盖率,确认抗体氨基酸序列(图2)[4]。N/C端序列可以结合氨基酸覆盖率结构来分析,确认末端序列与目的序列一致。
表2 常用蛋白酶的酶切位点
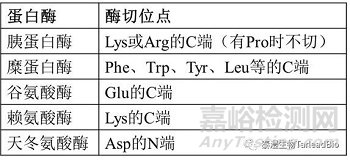

图2 抗体的肽图
从上至下分别为胰蛋白酶、赖氨酸酶和天冬氨酸酶酶切的肽图
2.翻译后修饰
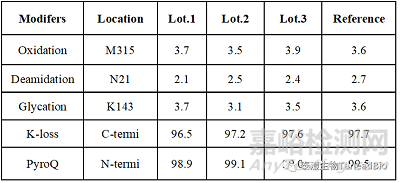
抗体分子在分泌、表达、纯化和贮存过程中,受细胞内和细胞外环境的影响,会发生翻译后修饰,常见的修饰有甲硫氨酸(Met)上的氧化(oxidation)、天冬酰胺(N)上的脱酰胺(deamidation)、N末端Q上的环化(pyroQ)和C末端丢失赖氨酸(K loss)等。这些修饰会引起抗体的局部构象和电荷发生变化,在IEF上表现出不同比例的酸碱峰。发生在CDR的修饰会影响活性,引起抗体药物治疗效果的下降。分析翻译后修饰和序列覆盖率的样本酶解方式相差不大,根据序列比对结果,计算翻译后修饰的位点和比例。翻译后修饰是酸碱峰表征和产品可比性研究中常见的检测项目。以某项目为例,在三批次产品的可比性研究中,对翻译后修饰进行表征,结果显示,三个批次产品和参比品之间的修饰类型和比例保持一致(表3)。值得注意的是,样本在处理过程中可能也会引入修饰,造成假阳性修饰,此时,可以使用低pH酶解条件等来降低样本处理引入的修饰。
表3 可比性研究中不同批次之间的翻译后修饰比例
3.N糖
单抗在重链CH2的N297位有保守的N糖基化位点(保守序列为NX-S/T),多抗和重组蛋白通常有更多的N糖基化位点。抗体在内质网中开始N糖基化,达到高尔基体(Golgi)后进一步糖基化,最终生成复杂的N糖糖型。抗体中常见的N糖糖型有G0、G0F、G1F、G2、G2F、Man5和Man8等。有研究显示,在IgG1中, 没有岩藻糖核心的糖(G0,G1等),会增强抗体与FcRIIa的结合,进而提高ADCC活性,因此,针对此特点可以开发不同岩藻糖化水平的抗体,控制ADCC活性。当高甘露糖(Man5,Man8等)比例高时,抗体在人体内的清除变快,降低抗体的治疗效果。
表征中确认N糖基化位点时,样本先用N糖苷酶PNGase F切掉N糖,糖基化位点的天冬酰胺残基发生脱氨基化,造成0.9840 Da的质量增加,经过酶解和LC-MS/MS分析,寻找发生+0.9840Da的天冬酰胺,确认N糖糖基化位点。
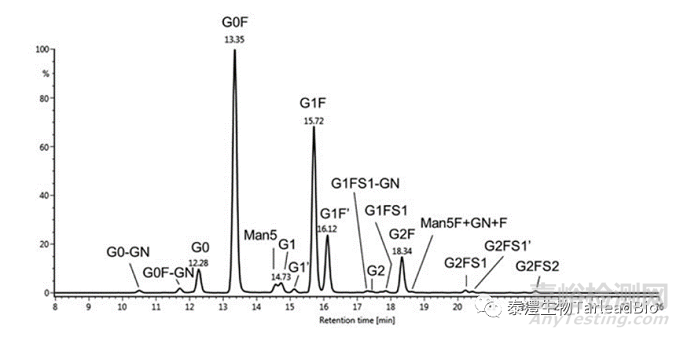
N糖糖型检测时使用特异性的N糖苷酶PNGase F切掉N糖,因为N糖本身不能发荧光,需要用荧光试剂标记N糖。常用的荧光标记试剂有2-AB、2-AA、RapiFulor-MS和InstantPC等,市面上均有成熟的试剂盒,也可以自己配制使用。用HILIC分离荧光标记的N糖,质谱检测分子量用于确定糖型,荧光检测器检测荧光强度用于定量,确定抗体的糖型和比例。图3是一个IgG1类型抗体的N糖糖型荧光光谱[5]。
图3 IgG1类型抗体的N糖糖型
4.高级结构
4.1.二硫键确认
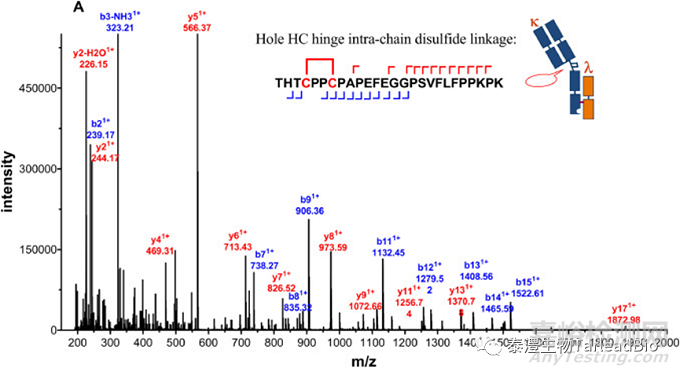
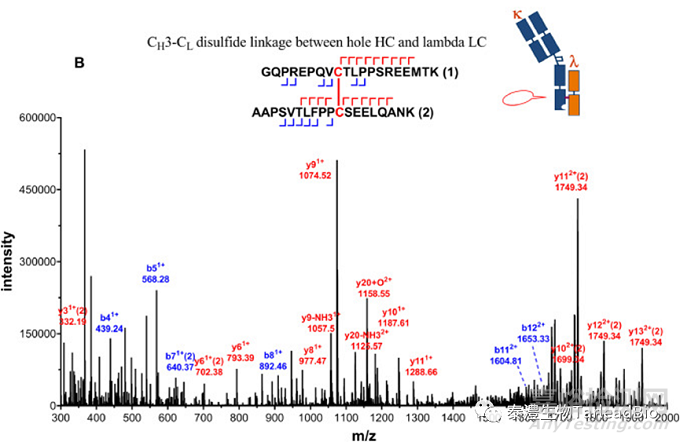
抗体的不同链之间通过二硫键链接,链内也有二硫键存在,以维持抗体的空间结构和活性。通常IgG1类型单抗有16个二硫键,双抗和多抗拥有更多的二硫键,重组蛋白的二硫键更错综复杂,链接形式也更加多样。二硫键链接方式直接和抗体的活性有关,错配会导致活性完全丧失,因此有必要利用质谱技术来表征样本的二硫键链接方式。样本在非还原状态下经过特异性酶切,在LC-MS上检测分析,利用串级数据,得到二硫键配对结果(图4)[3]。
图4 用LC MS/MS方法确认抗体的铰链区(A)及重链-轻链链间(B)二硫键
4.2. 圆二色性
抗体的高级结构是由主链折叠产生,如α螺旋、β折叠、转角等,这些不对称结构使得抗体具有圆二色性。圆二色谱(Circular Dichroism,CD)法利用抗体的圆二色性和分子的不对称性,根据左右偏振光吸收的不同来解析抗体的高级结构。远紫外区(190-230mm)光谱可反映抗体的二级结构,α螺旋、β折叠、转角和不规则卷曲的比例。近紫外区(250-350mm)光谱反映抗体的三级结构变化,侧链生色基团如色氨酸、苯丙氨酸、酪氨酸的排布信息和二硫键微环境的变化。
4.3. 热稳定性
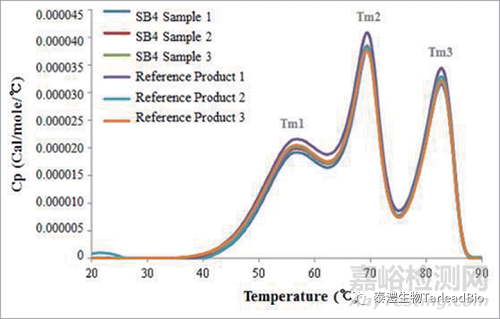
通常用DSC(differential scanning calorimetry)来表征抗体的热稳定性,用Tm(溶解温度)表示,Tm越高表示抗体分子越稳定。图5是生物类似药与原研药表征时Tm的比较[4],两者有类似的Tm1、Tm2和Tm3,说明类似药与原研药的高级结构一致。
图5 生物类似药与原研药的Tm值比较
5.生物学活性
抗体活性可以分为Fc相关的亲和力活性和细胞活性,是抗体发挥肿瘤杀伤活性的的发生机制。亲和力结合活性比如Fc片段与FcγRIa、FcγRIIa、FcγRIIb、FcγRIIIa、FcγRIIIb、FcRn和C1q的结合活性,依据抗体的MOA设计实验。抗体依赖的细胞毒性ADCC是抗体的Fc端与效应细胞(主要是NK)表面的Fc受体(如FcγRIIIa/CD16)结合,介导效应细胞杀伤肿瘤细胞。补体依赖的细胞毒性CDC是抗体Fc与补体系统的C1q结合,激活经典补体通路,经过一系列的信号放大,在靶细胞表面形成膜攻击复合物,引起靶细胞裂解。常见的活性检测方法有表面等离子共振和生物膜干涉等方法。
参考文献
1.EMA. Guideline on Development, Production, Characterization and Specifications for Monoclonal Antibodies and Related Products (London, Dec. 2008).
2.ICH. Q6B Test Procedures and Acceptance Criteria for Biotechnological/Biological Products (1999).
3.Cao MY, et al. Characterization and Monitoring of a Novel Light-heavy-light Chain Mispair in a Therapeutic Bispecific Antibody. Journal of Pharmaceutical Sciences, 2021(110):2904-2915
4.Cho IH,et al. Evaluation of the structural, physicochemical, and biological characteristics of SB4, a biosimilar of etanercept. mAbs, 2016(8):1136-1155
5.Upton R,et al. Evaluating N-Glycosylation of a Therapeutic Monoclonal Antibody Using UHPLC-FLR-MS with RapiFluor-MS Labeling. Mass Spectrometry of Glycoproteins:189-203