您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2023-03-25 18:37
近日,国家药监局发布《化学仿制药参比制剂调整程序(试行)》,内容如下:
化学仿制药参比制剂调整程序(试行)
为规范化学仿制药参比制剂调整工作,特制定本程序。
一、调整情形
《仿制药参比制剂目录》收载的参比制剂,经评估已不再符合参比制剂遴选原则的,属于本程序调整范围。品种的具体情形包括:
(一)因安全或有效性原因撤市。
(二)经技术改进,仍无法符合现行《中国药典》或审评技术要求,不鼓励仿制。
(三)其他经评估不再符合参比制剂遴选原则的情形。
二、调整申请的提出
药品生产及研发企业、行业协会及药审中心根据以上调整情形,可对国家药监局已发布的参比制剂提出参比制剂调整申请。企业、行业协会可通过参比制剂遴选平台“参比制剂存疑品种申请”模块提交调整申请表,并提交充分的论证材料。
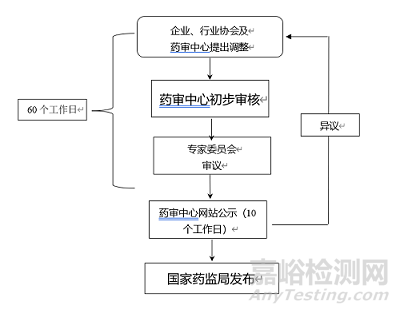
三、调整程序
(一)药审中心初步审核
药审中心对参比制剂调整申请进行初步审核,形成初步审核意见提交专家委员会审议。
(二)专家审议
药审中心在收到申请后,按照相关管理规定和程序组织专家委员会对调整申请进行审议。审议结论分为同意和不同意,专家就审议结论进行投票,审议结论以超过半数以上的专家意见为准。
(三)对外公示
药审中心在收到申请后60个工作日内,公示审议结果,公示期为10个工作日。
(四)异议处理
对外公示结束后,药审中心对收到的异议按照以下方式处理:
1.经审核认为,异议未提供新的证据,且所提的异议意见已在专家审议会上进行过充分研究,并有明确审议结论的,药审中心维持原审议结论,不再组织专家进一步审议,于45个工作日内予以答复。
2.经审核认为,异议提供了新的证据,且需进一步研究的,药审中心再次组织专家会审议。原则上,会议应邀请该品种的利益相关方参加,审议结果于60个工作日内对外公示。原则上同一问题专家委员会论证不超过2次。
(五)发布
经以上程序确定需调出参比制剂目录的品种,报国家药监局发布。
化学仿制药参比制剂调整流程图
化学仿制药参比制剂调整申请表
|
序号 |
药品通用名称 |
英文名称/商品名 |
规格 |
持证商 |
备注1 |
备注2 |
|
|
|
|
|
|
|
|
|
调整情形 |
情形(一) □ |
情形(二) □ |
情形(三) □ |
|||
|
申请单位 |
|
联系方式 |
|
|||
|
调整 理由 |
|
|||||
|
附件 论证性 材料 |
根据调整情形提交相关证明性资料。 |
|||||
单位名称(公章):
年 月 日
化学仿制药参比制剂调整异议申请表
|
公示序号 |
|
药品通用名 |
|
药品规格 |
|
|
异议单位 |
|
联系方式 |
|
||
|
异议事项 内容及 理由 |
|
||||
|
附件 论证性 材料 |
|
||||
单位名称(公章):
年 月 日
《化学仿制药参比制剂调整程序(试行)》政策解读
一、制定《化学仿制药参比制剂调整程序》的目的是什么?
为促进我国仿制药高质量研发,国家药监局深化药品审评审批改革,确立参比制剂在仿制药研究中的标杆作用,严格按照《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号)要求遴选发布参比制剂。自2016年启动参比制剂遴选工作以来,已发布参比制剂66批,共2408个品种,6174个品规,为仿制药研发审评和仿制药质量和疗效一致性评价工作提供了有力支持。
随着制药技术的不断发展进步,在药品审评过程中发现个别参比制剂已不符合现行《中国药典》或现行审评技术要求,不鼓励仿制,还有个别参比制剂因安全或有效性原因撤市。为保障我国仿制药研发质量水平,有必要借鉴国际惯例,对参比制剂目录实施动态管理,及时将不符合参比制剂要求的品种调出参比制剂目录。为此,国家药监局根据《药品管理法》《药品注册管理办法》《化学仿制药参比制剂遴选与确定程序》,经过充分调研论证,广泛征求业界专家意见,研究制定了《化学仿制药参比制剂调整程序(试行)》,确保参比制剂调整工作科学规范。化学仿制药参比制剂调整程序中也明确了参比制剂调整的情形和提出路径,设置了公示及异议处理流程,让业界充分参与论证和审议,确保调整工作公开透明。
二、调整情形(一)适用于什么样的情形?
《仿制药参比制剂目录》收载的参比制剂,因安全或有效性原因经我国药品监管部门评估撤市的,参比制剂目录中本品所有参比制剂应予调出。如参比制剂来源于国外,参比制剂来源国因安全或有效性原因,将列为参比制剂的品种撤市的,按照本程序,经充分评估认为风险大于获益的,参比制剂目录中相应品种应予调出。
三、因非安全或有效性原因撤市的药品,参比制剂是否调整?
被遴选为参比制剂的药品,在参比制剂来源国因非安全或有效性原因撤市的,参比制剂目录中参比制剂不做调整。
四、调整情形(二)适用于什么样的情形?
现行《中国药典》或审评技术要求随着科学技术进步,在不断优化改进。目前国内外上市的部分药品,经过技术改进仍无法符合现行《中国药典》或审评技术要求,经评估不鼓励仿制。例如:已有符合终端灭菌工艺要求上市的注射剂,对于采用非终端灭菌工艺生产的相同活性成分的注射剂不鼓励仿制等。
五、调整情形(三)适用于什么样的情形?
调整情形(一)(二)以外,按照本程序评估认为不再符合参比制剂遴选原则的情形。
六、参比制剂调出目录后,其他在审和已上市化学仿制药同品种如何处理?
按照本程序调出参比制剂目录的品种,自参比制剂调整公告发布之日起不再作为参比制剂。
属于情形一的品种,在审的仿制药上市申请和仿制药质量和疗效一致性评价申请不予批准,已上市药品按照《药品管理法》《药品管理法实施条例》有关规定办理。
属于情形二、三的品种,在审仿制药上市申请批准后,不纳入《上市药品目录集》;在审仿制药质量和疗效一致性评价申请按照上市后变更补充申请审评,批准后不适用一致性评价有关政策;已批准上市或通过仿制药质量和疗效一致性评价的仿制药品,同步调出《上市药品目录集》,说明书、标签不再使用通过一致性评价标识,药品上市许可持有人应于参比制剂目录调整公告发布之日起3个月内按照《药品上市后变更管理办法(试行)》有关规定,提出说明书、标签修订备案。

来源:国家药监局


