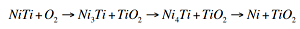笔者从上周末起,就在不断地思考这个问题,感谢天天烧锅炉的几位机械和材料工程师朋友们的不吝赐教,今天终于斗胆提笔了,希望行业里的大神们轻拍。首先破除一个常见的错觉,那就是所有金属都会氧化,包括支架的各类材料如不锈钢、钴铬合金、镍钛合金,等等,不是不氧化,只是时机未到。然而这些氧化是否能统称为“锈”(贬义),仍是一个值得商榷的问题,因为氧化固然有它的不好,但也有它的保护作用。
图1 镍钛合金的氧化公式
图2 2018年,广州大学土木工程学院的老师们与The University of Western Australia的研究者,共同发表“镍钛表面氧化及其对热力学性能的影响”一文,提到在高温空气环境下,镍钛金属的表面氧化以特定的顺序形成了不同产物层,这些氧化相关层的形成和下方的贫钛区,导致金属的临界应力增加与潜热(lantent heat)显著降低
对支架有所了解的筒子们应该都晓得,医用镍钛植入物的定形热处理大多是在空气中进行的,仅很少一部分会放在真空或惰性气体环境中,以避免氧化。针对激光雕刻支架,我们可以采取抛光或其它前处理方式,来减少热处理后的氧化层;而对编织支架,处理就会困难一些(甚至有时候干脆就不处理了);到了瓣膜支架,所有的前处理都必须在手工缝瓣前完成,所以不同设计的支架各有各的工艺需求与特点,但这里的底层逻辑却仍是相通的。包括抛光在内的所有前处理方式,一方面固然是为了去除氧化层(当然也做不到100%),另一方面也有着去除支架表面杂质,修饰支架表面等其它的功用,甚至还有促进形成一层新生致密氧化膜的作用。
早在1998年,加拿大Ecole Polytechnique de Montreal的研究者们已报道指出,表面氧化似乎有希望提升镍钛金属的耐腐蚀性和生物相容性,他们认为包括电解抛光、热处理和硝酸钝化在内的处理方式,均能使金属表面塑形变性的原生氧化层被去除,代之以新生长的、更均匀的氧化层,从而提高了合金的耐腐蚀性。是故,氧化层的均匀性,而不是其厚度和成分,似乎是影响耐腐蚀性的主要因素。致密的氧化膜反而能阻止镍离子和钛离子的析出,但这里主要指的是薄纯钛氧化层,因其相比含镍氧化物具有更高的耐腐蚀性。
当然,作为镍钛支架的研究,这类文章实在太多了,一一看过来也太考验眼力了,今天,我们还是仅专注于FDA工程师们与Confluent Medical Technologies(这家应该很有名了,当然除它以外的国内外供应商也不少)的工程师们于2017年,共同发表的“The effects of surface processing on in-vivo corrosion of Nitinol stents in a porcine model”一文。
图3 本文的第一作者,Stacey J.L.Sullivan博士,机械工程师,FDA科学与工程实验办公室应用力学部Oak Ridge Institute for Science and Education (ORISE) 研究员
图4 Confluent Medical Technologies公司
金属支架的腐蚀副产物会引起炎症细胞反应,导致再狭窄;这点对镍钛锘植入物尤为重要,因镍金属可引起过敏反应、肾毒性和致癌性(当然就支架那点量也太小了,一般还是不会的)。为帮助医疗器械制造商对金属支架进行腐蚀性评估,FDA在2021年又更新了一遍指南,时间所限本文中还是前一版,但是体外测试的推荐方法,仍是依据ASTM F2129(Standard Test Method for Conducting Cyclic Potentiodynamic Polarization Measurements to Determine the Corrosion Susceptibility of Small Implant Devices)的循环动电位极化标准测试方法(这个中国标准也有,甚至B站的视频都有,大家感兴趣的可自行搜索)。本次研究者们主要评估,镍钛合金支架表面开始点蚀时,所需的电压,也即击穿电位(Breakdown potential,Eb)(电流快速增加100倍时的电位),一般击穿电位超过600mV证实植入物的耐腐蚀性能可接受,低于300mV则不可接受。
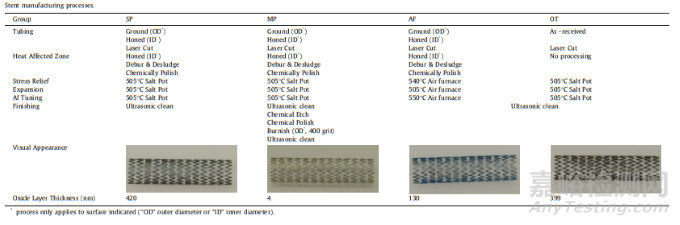
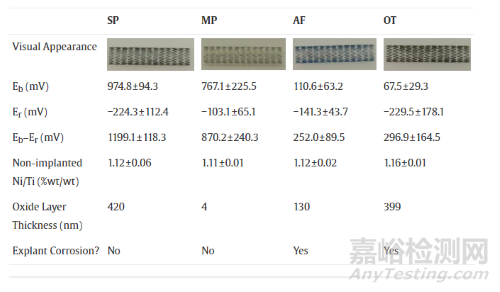
Confluent Medical Technologies公司提供的镍钛锘支架样品是8*30mm的统一规格,为研究不同的表面处理方式的区别,进行了四种独特的处理:盐浴热处理炉热处理(Salt Pot,SP)、机械抛光(Mechanical Polish,MP)、空气炉热处理(Air Furnace)、切割前带原始氧化层的金属管(Oxidized Tube,OT),如下图5,注意不同表面处理的镍钛锘支架氧化层厚度(下图最下面一行小字)由Auger Electron Spectroscopy(Physical Electronics)通过半峰全宽法测定。
图5 本研究中,不同处理方式支架的制造工艺
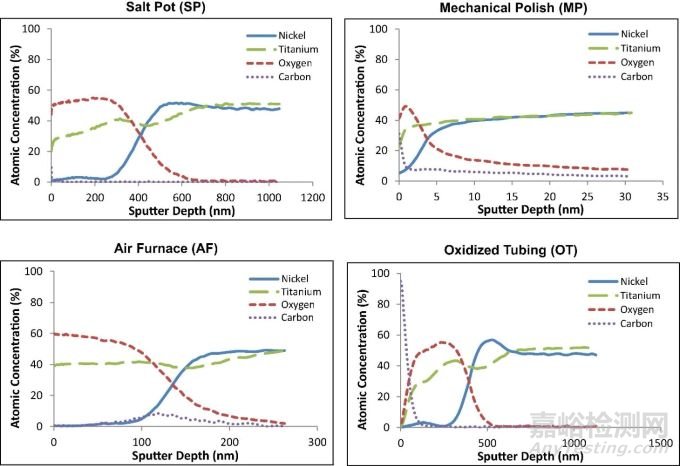
将四种支架植入小型猪髂动脉内进行长期研究,每支架组3根,在6个月的植入期间每只猪每天服用81mg阿司匹林和75mg氯吡格雷。6月后处死动物,用基于木瓜蛋白酶的组织消化溶液来去除支架周围的血管组织,随后将支架风干储存以用于腐蚀分析(风干储存~)。每组支架呈现出了不同的颜色,提示其独特的氧化层:SP支架氧化层较厚(420nm)表面呈黑色,氧化钛层下方是富镍区域。相比之下,MP支架的薄氧化层(4nm),具有光明、闪亮的金属外观,且不存在富镍层。AF支架具有约130nm的氧化物层,外观呈金属蓝色,并略微存在富镍层。OT支架的外观则暗淡无光,在399nm的氧化钛层下有一个富镍区域。
图6 不同组支架表面的Auger深度图,显示了氧化层的化学成分和其它成分
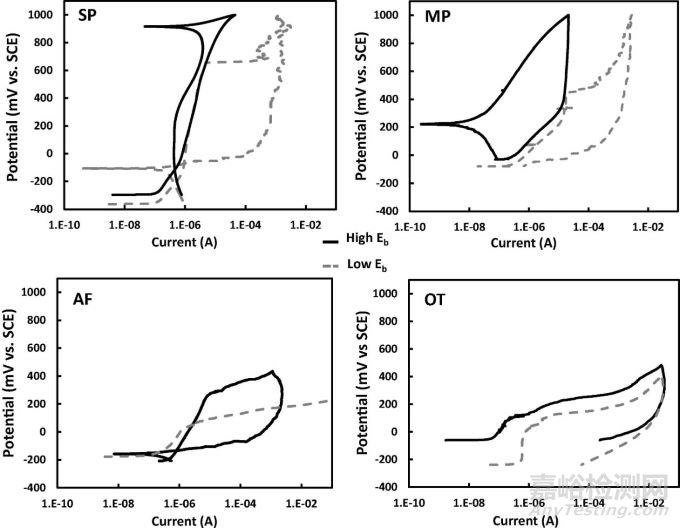
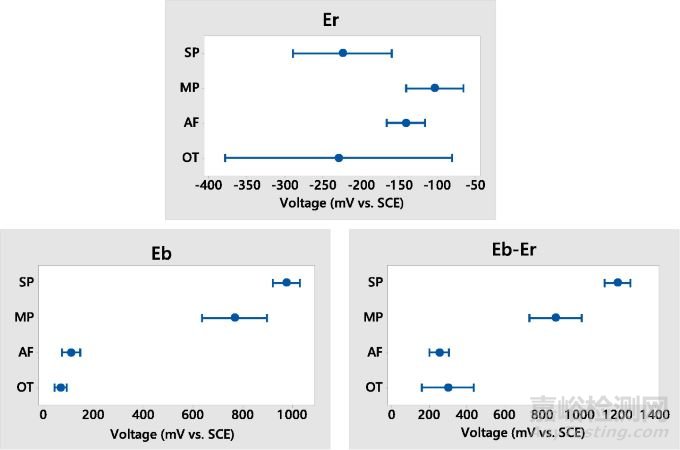
进一步依据ASTM F2129进行的点蚀测试表明,SP、MP、AF和OT支架间的动电位行为明显不同。与SP和OT支架相比,MP支架的静息电位明显更高(p<0.033);SP支架表现出了最高的耐点蚀特性,其中只有1/14(7%)的支架出现破裂(SP支架氧化层厚度较高)。与之相反,所有AF支架(14/14)都出现了故障;MP支架则具有第二高的击穿可能性,10/14(71%)的支架出现了击穿。除AF和OT支架外,每个支架组的击穿电位间存在统计学差异(p≤0.001)。
图7 不同支架组的动电位极化曲线,显示了最小击穿(灰色虚线)和最大击穿(黑色实线)
图8 从ASTM F2129测试中获得的静止电位(Er)、击穿电位(Eb)和过电位(Eb-Er)的95%置信区间
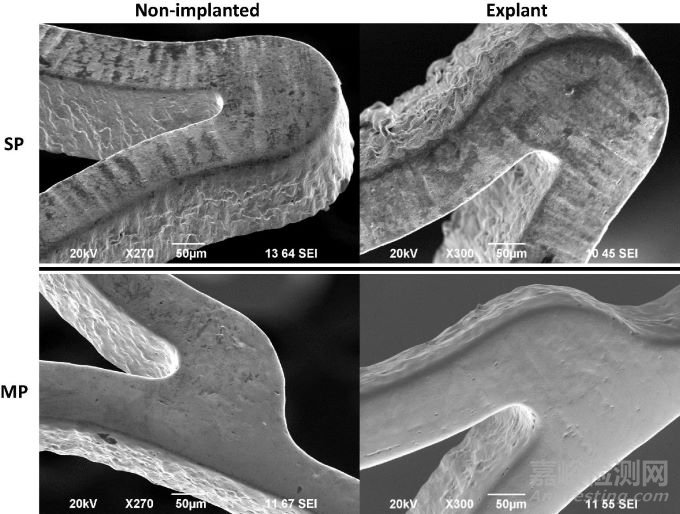
在非植入动物体内和植入支架的外观比较中,SP和MP植入支架均未显示出点蚀的视觉或元素证据,两款支架均表现出与非植入时相似的形态。如下图9,MP支架始终具有光滑一致的表面,SP支架则相对不那么光滑,内弧面处有细小的表面裂纹,可能是支架压接和展开过程所致。SP支架非植入与植入的Ni/Ti比率没有显著差异(1.12±0.06,n=13 vs 1.11±0.03,n=47;p=0.470),这点,MP支架也相似(1.11±0.01,n=14 vs 1.13±0.04,n=36;p=0.878)。
MP支架是本研究中唯一采用抛光作为最终处理步骤以去除热处理产生的热氧化物的支架,尽管它有较广的击穿电位范围,如上图8,但在体内6月显示出了良好的耐腐蚀性。与此同时,具有复杂热氧化物的SP支架,也显示出了有效防止点蚀的能力,即使存在微裂纹的情况下,SP支架也未观察到腐蚀,这可能是由于氧化层较厚,而使得裂纹停留在氧化层的缘故。但是,SP的厚氧化物虽有助于抵抗点蚀,但不够薄以承受引起支架开裂和镍浸出的压接应变。
图9 (左)非植入与(右)植入动物体内的SP和MP支架的代表性电镜SEM图像
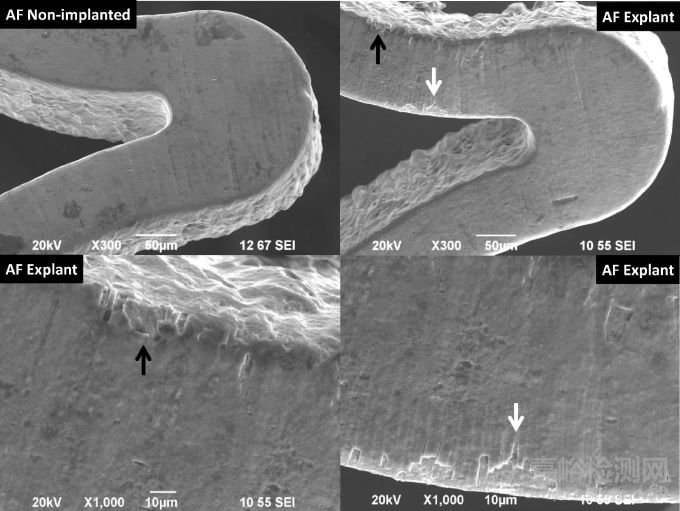
不幸的是,植入体内的AF支架表现出了明显的腐蚀区域;同时在非植入的AF支架表面,观察到了更明显的杂质。与未植入的AF支架相比,植入支架的未腐蚀区域的平均Ni/Ti比率约低了3%(1.12±0.02,n=12 vs 1.08±0.15,n=24;p=0.018),视觉腐蚀区域则低17-20%(0.89±0.15,n=24;p≤0.001)。AF支架采用常见的加工方法来去除原始管材中的原始氧化物,并去除了激光切割后的热影响区,但并没有抛光/钝化,类似于第一代激光切割镍钛合金支架。
图10 (左上)非植入与(右上)植入动物体内的AF支架的代表性SEM图像,放大显示沿着支架边缘内弧面的开裂和腐蚀(左下),暴露出基材(右下)
图11 植入AF支架中,所观察到的不同腐蚀案例。(a)周围无裂纹的腐蚀;(b)裂纹驱使氧化物“起泡”;(c)腐蚀形成的“晕圈”;下一排图为所对应上一图的放大图像
图12 AF支架腐蚀处的高倍放大图像。(a)氧化层部分完好,裂纹位置出现表面下腐蚀;(b)氧化物从表面完全分层;下一排图为对应上一图的背散射电子合成图像,氧化物显示为深灰色,裸露的金属则为亮区域
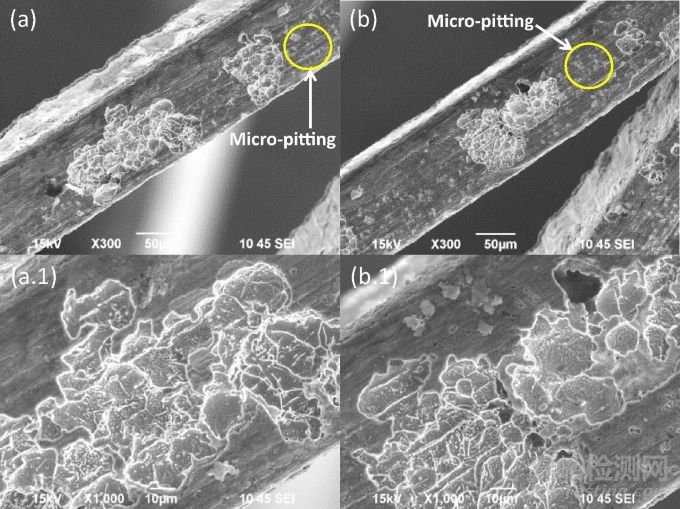
最后,非植入的OT支架具有四组中最粗糙的表面,带有明显的拉线和划痕。植入的OT支架出现外表面的大凹坑,这些凹坑渗透进入大量镍钛合金材料中,并伴有周围氧化层中的微坑。在某些区域,凹坑聚结,几乎腐蚀了整个支架的宽度。非腐蚀区域的Ni/Ti比率降低,但没有显著差异(1.16±0.10,n=20 vs 1.05±0.31,n=32;p=0.095),凹坑区域的Ni/Ti比率与未植入支架表面也没有明显差异。OT支架是本文研究者们有意识制造的最少加工支架,具有最低的击穿电位,氧化物层厚度变化非常大(200-1000nm),无法保护植入物免受体内电化学环境的影响。
图13 (左)非植入与(右)植入动物体内的OT支架的代表性电镜SEM图像
图14 OT支架中观察到的深坑点蚀代表性图像,同样的,下一排图为上一对应图的放大图像
图15 OT支架广泛腐蚀区域附近的微点蚀(黄色圆圈),下一行为上一对应图的放大图像
作为首个比较金属支架体外和体内腐蚀性能的报道(是的虽然支架诞生了有50多年了~),研究者们证实了击穿电位<约200mV的支架显示出了体内局部腐蚀的证据,而击穿电位>约600mV的支架则没有。但是本研究的缺陷同时也很明显,由于临床支架植入体内的时间往往>10年,因此目前这些工艺支架的长期耐腐蚀性仍不明,特别是对于本文中表现出优异特性、具有厚氧化物层的SP支架。
图16 不同工艺支架的特征与表现总结
引用文献:
1. Abdus Mahmud, Zhigang Wu, Junsong Zhang, et al. Surface oxidation of NiTi and its effects on thermal and mechanical properties. Intermetallics 103(2018): 52-62.
2. Paul Johan Hol, Nils R. Gjerdet, Torbjorn Jonung. Corrosion and metal release from overlapping arterial stents under mechanical and electrochemical stress-an experimental study. Journal of the Mechanical Behaviour of Biomedical Materials 93(2019): 31-35.
3. Stacey J.L. Sullivan, Daniel Madamba, Shiril Sivan, et al. The effects of surface processing on in-vivo corrosion of Nitinol stents in a porcine model. Acta Biomaterial 62(2017): 385-396.
4. Christine Trepanier, Maryam Tabrizian, L’Hocine Yahia, et al. Effect of modification of oxide layer on NiTi stent corrosion resistance. John Wiley & Sons, Inc. J Biomed Mater Res. (Appl Biomater) 43: 433-440, 1998.
5. Chun-Che Shih, Shing-Jong Lin, Kwok-Hung Chung, et al. Increased corrosion resistance of stent material by converting current surface film of polycrystalline oxide into amorphous oxide. J Biomed Mater Res, 52, 323-332, 2000.