摘要
方法:通过分析加拿大处方药与非处方药分类管理制度内容和经验,提出完善我国处方药与非处方药分类管理的思路。
结果与结论 :按照处方药与非处方药分类,加拿大将药品分为第Ⅰ类药品、第Ⅱ类药品、第Ⅲ类药品和未分类药品,并对药品分类确立了具体评价因素和管理要求,建有一套比较系统的管理制度、体系和技术标准,这对完善我国处方药与非处方药分类管理制度具有参考和借鉴价值。笔者建议借鉴加拿大处方药和非处方药制度和管理模式,进一步完善我国药品分类管理制度和配套政策,加强处方药和非处方药的精细化分类管理,完善分类注册和转换审查标准。
药品安全是重大的民生和公共安全问题,事关公众的身体健康和社会和谐。处方药与非处方药分类管理制度是一项药品管理的基本制度。1999年,原国家药品监督管理局颁布《处方药与非处方药分类管理办法(试行)》,标志着我国正式实施药品分类管理制度。经过20余年的发展,我国已逐步建立起了药品分类管理制度体系。国家药品监督管理局公布的我国遴选与转换非处方药目录中,以药品通用名计,中成药共计3900余个,包括1999-2004年通过遴选的中成药3406个,2005-2019年通过转换评价的中成药535个,另有25个中成药从非处方药转换为处方药管理[1]。与发达国家比较,我国药品分类管理制度还存在监管机制尚不健全、法律法规不完备、制度执行不到位等问题。国家药品监督管理局目前正在组织相关部门研究完善处方药与非处方药的分类管理制度。在国际上,加拿大在借鉴美国、英国药品分类管理制度的基础上,经过长时间的实践积累,形成了一套较为成熟、完整和科学的处方药与非处方药分类管理制度。国内学术界注重对美国、日本等国家的处方药与非处方药分类管理研究,但还缺少对加拿大制度成果的研究。通过对加拿大处方药与非处方药分类管理制度研究,可为完善我国处方药与非处方药的管理提供借鉴和参考。笔者在本文中对加拿大处方药与非处方药分类管理的制度安排和技术标准等进行研究分析,为完善我国处方药与非处方药分类管理提供借鉴。
1、加拿大药品分类管理机构和法律依据
1.1 加拿大药品分类管理机构
1.1.1 加拿大卫生部
加拿大宏观药品管理系统设置在加拿大卫生部(Health Canada),各地区设卫生总干事,加拿大卫生部与各省/地区共同负责药品监管工作。加拿大卫生部下设健康产品和食品局(Health Products andFood Branch),负责对健康产品和食品的安全性、有效性和质量进行评估监测,对药品临床前试验、临床试验、产品申请监管、上市许可、药物警戒进行监督管理。
健康产品和食品局下设的药品管理专门委员会(Pharmaceutical Drugs Directorate,PPD)是处方药管理的主要机构,其核心工作是按照《食品和药品法》(Food and Drug Act)及其条例对加拿大人用处方药进行安全性、有效性和质量要求的验证,评估处方药潜在益处和风险,审查不良反应报告等。
非处方药在加拿大卫生部作为自我护理产品(self-careproducts)的一种,由健康产品和食品局下设的天然和非处方健康产品管理委员会(Natural and Non-prescriptionHealth Products Directorate,NNHPD)进行管理,主要的监管范围为非处方药安全性、有效性和质量审查,以及确保非处方药 使用的安全性及降低非处方药健康风险[2]。
1.1.2 全国药房监管机构协会
全国药房监管机构协会(National Association of Pharmacy Regulatory Authorities,NAPRA)作为一个非营利机构,是加拿大各省/地区药房监管机构和加拿大军队药房服务的联盟。NAPRA承担统一加拿大药品销售条件并对药房进行监督管理的职责 ,并 实 施 国 家 药 品 目 录(National Drug Schedules,NDS)计划[3]。经过加拿大卫生部审评和获得上市授权许可的非处方药,将交由NAPRA对其进行进一步的分类管理和评价。NAPRA下设的国家药品目录分类咨询委员会(National Drug Scheduling Advisory Committee,NDSAC)负责开展药品目录分类审查工作并给出临时药品目录分类建议,NAPRA董事会将会根据NDSAC的临时建议和社会公共利益,给出药品目录分类的最终建议,随后修订 NDS 并实施。NDS 作为各省和地区药品目录的标准,特殊情况下各省/地区可以在此基础上加以限定。
1.2 加拿大药品分类管理立法体系
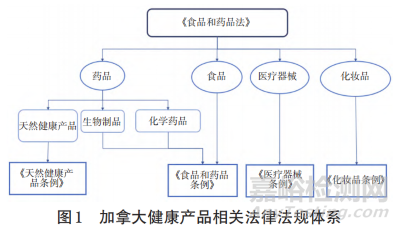
加拿大处方药和非处方药监管主要依据和参考《食品和药品法》《食品和药品条例》(Food and Drug Regula‐tions)及其附表的规定和要求。受管制的药品和物品,还要遵守《受管制药品和物品法》(Controlled Drugs andSubstances Act)及其附录的规定和要求[4]。各类产品在此分类基础上有相对应的法规进行监管和约束。加拿大健康产品相关法律法规体系见图1。
2、加拿大处方药与非处方药分类管理
2.1 处方药与非处方药的分类
根据加拿大的《食品和药品法》,药品包括制造、销售或出现在以下任一用途的任何物质或物质混合物:(1)对人类或动物的疾病、紊乱或异常身体状态或其症状的诊断、治疗、缓解或预防;(2)恢复、纠正或改变人类或动物的机体功能;(3)用于生产、制备或贮存食物场所的消毒[5]。
根据处方药与非处方药分类管理属性,药品包括天然健康产品、生物制品和化学药品。药品又可进一步细分为 4 类,分别为第Ⅰ类药品(schedule Ⅰ drugs)、第Ⅱ类 药 品(schedule Ⅱ drugs)、第Ⅲ类 药 品(schedule Ⅲdrugs)和未分类药品(unscheduled drugs)。第Ⅰ类药品是处方药,另外3类为非处方药。具体的健康产品和药品分类关系见图2。
2.2 处方药的界定和目录管理
根据《食品和药品法》,处方药指的是列入处方药目录(prescription drug list,PDL)的药品,即第Ⅰ类药品。受管制的药品虽不列入PDL,但在管理中也需要医师处方才能在药房进行调配。第Ⅰ类药品目录现收录1848种。处方药即按照处方药来源可分为2类:第一类为列入 PDL 的药品,其中人用产品(products for human use)1391种;第二类为PDL外、需处方才能销售的药品——包括列入《受管制药品和物品法》《麻醉品管制条例》等法规或条例中的特殊管理药品。
2.3 非处方药界定与分类
2.3.1 非处方药的界定
非处方药(non-prescriptiondrug)是指无须医师处方就可以在药房销售和消费者自我药疗的药品[6]。除《食品和药品条例》和《麻醉药品管理条例》(Narcotic Control Regulations)规定的凭处方销售的药品和专门用于动物的药品外,其余均为非处方药。
2.3.2 非处方药分类
根据NAPRA和NDS,非处方药分为第Ⅱ类、第Ⅲ类和未分类药品[7]。
第Ⅱ类药品即不需要医师处方,但销售前需要药师做评估和专业干预才能销售的非处方药品,被称为“柜台后面的药品”[behind-the-counter (BTC) drug]。现NDS目录中收录153种。
第Ⅲ类药品即不需要医师处方,必须在有执照的药房出售,又可以在药房药师监督到的自选区域出售的药品,被称为“开架药品”[open-shelf (OPS) drug]。现NDS目录中收录85种。这些药品可放在药房中开架区域供消费者自主选择,但是如果有需要时,药师可对消费者的自主选择提供协助。
未分类药品,这一类药品类似于美国和欧盟的“一般销售清单药品”[general sale list (GSL) drug],是指不需要医师处方,可在没有专业药师监督的零售店或超市出售的非处方药。现NDS目录中约有49种。
2.3.3 天然健康产品
加拿大的天然健康产品(naturalhealth products,NHPs)是指自然产生的用来保持或恢复健康的物质[8]。NHPs 基本上包括“膳食补充剂”产品、“草药”“益生菌”“传统药物”及“顺势疗法药物”等类别。中药在加拿大注册一般按天然健康产品的要求执行。目前NNHPD对天然健康产品的监管工作主要包括天然健康产品的安全、有效和质量审查,天然健康产品的生产,上市后监测等方面[9]。从 2024 年起,所有具有加拿大卫生部天然健康产品编号(natural product number,NPN)的产品或药物识别编号的顺势疗法药物(drugidentification number-homeopathic medicine,DIN-HM)的产品都将不再列入 NDS [10],具有 NPN 或 DIN-HM 将会被列入天然健康产品数据库(Licensed Natural HealthProducts Database),根据《天然健康产品条例》(NaturalHealth Product Regulations)进行管理[11]。
3、加拿大处方药和非处方药的分类申请、审评与转换
3.1 处方药和非处方药的分类申请
处方药的上市申请,按照相应要求向加拿大卫生部药品管理委员会提交新药申请(new drug submission)。非处方药上市途径分为2种:一是新药申请途径或新药补充申请途径,对于现有处方药转换为非处方药,根据药品的自身属性和临床使用情况向加拿大卫生部药品管理委员会提交申请,部分转换申请提交新药申请,完全 转 换 申 请 提 交 新 药 补 充 申 请(supplement to a newdrug submission)[12];二是非处方药专论途径,对于符合非处方药第 4 类专论(non-prescription drug category Ⅳmonograph)要求和规定的产品,可以向NNHPD递交非处方药专论申请[13]。
药品经过加拿大卫生部审评确定为非处方药后,制药企业即可向NAPRA提出国家药品目录分类申请。NDSAC负责对NAPRA收到的非处方药分类申请进行审评,并给出药品目录分类建议。非处方药分类申请和审评将依据《第二号法规》(Bylaw No.2)和《议事规则》(Rules of Procedure)的要求和规定开展[14]。
申请材料应包含以下部分[15]:(1)索引;(2)申请药品目录建议的声明;(3)药品概述,包括使用条件、安全性和有效性、不良反应事件描述和发生率、相关的过量服用经验;(4)目录分类考量因素的使用,并附上相应的包含文献检索参数的文献引用表(为与药品目录分类的级联原则保持一致,申请应充分考量各目录分类因素,以支持该药品的目录分类申请);(5)建议的产品标签,包括为委员会(Drugs Directorate)准备的标准标签或专论;(6)与目录分类申请一致的市场消费者使用研究结果,以符合合规性等相关要求,如药品标签阅读和理解力研究、患者信息(对非处方药)等;(7)药品在其他国家的状况;(8)风险评估(市场渗透);(9)当目录分类申请是根据放松管制提案提出时,申请人将向委员会提供审查员使用的背景信息和评估的摘要。
3.2 处方药和非处方药的分类审评与转换
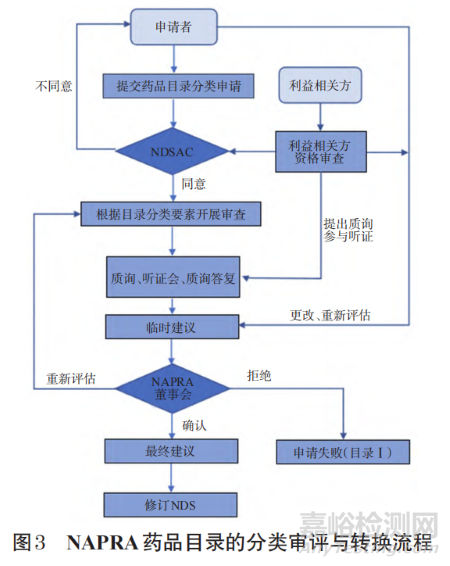
NDSAC和NAPRA从社会公共利益的角度出发,按照规定的程序,充分考虑目录分类因素,综合考虑非处方安全、有效和质量3个标准及消费者正确自我药疗要求,并参考利益相关方的意见和建议,对非处方药开展科学、公平和公正的分类审查工作。NAPRA药品目录分类审评与转换流程见图3。未向NAPRA递交非处方药分类申请的新非处方药或解除管制并转换为非处方药的药品仍自动按第Ⅰ类执行,即按照处方药要求进行管理。非处方药的重新评估和转换申请与非处方药分类审评程序相同。
3.3 处方药与非处方药分类评价考量因素
为保护公共利益和自我药疗的安全性,NAPRA 制定了各类药品分类评价因素。现NDSAC使用《全国药品目录分类评价考量因素》(National Drug SchedulingFactors)和《第 Ⅱ 类 和 第 Ⅲ 类 药 品 补 充 实 践 标 准》(Supplemental Standards of Practice for Schedule Ⅱ andⅢ Products,以下简称《实践标准》)附录 A :NDSAC 国家药品目录建议分类评价因素(Appendix A Factors Con‐sidered by NDSAC for National Drug Recommendations)进行综合评价[16―17(] 见表1)。在NAPRA相应指南中,特别说明“因素”并不是“标准”,由于因素之间具有的偶然性(contingent)、附 条 件(conditional)和 依 赖 性(depen‐dent),因素被认为是更合适的分类评测工具(assess‐ment tools)。在使用因素的过程中,为得到最适合的分类建议,审查者被允许对各因素进行判断和取舍以找到最合适的;同时当出现新知识或新实践经验时,NAPRA鼓励对目录内药品进行重新评估。
药品分类和非处方药分类审查应根据“级联原则”[18]:首先根据第Ⅰ类药品的考量因素对药品进行审查。若有适用的因素,则将该药品保留在该类药品目录中,确定为第Ⅰ类药品。若无,则根据第Ⅱ类药品的考量因素审查药品,符合者归属于该类药品;若不符合,根据第Ⅲ类药品的考量因素进行审查,依次递减。若药品不符合任何类别药品的考量因素,其就可归类于第4类“未分类药品”。
4、加拿大处方药和非处方药的经营与使用管理
为进一步规范处方药和非处方药的经营与使用管理,促进消费者安全、有效地使用药物,NAPRA对各类药品经营与使用管理提出了具体要求[19(] 见表2),且为药师制定了有关消费者安全有效使用药品所需的专业干预和建议的《实践标准》。其在《实践标准》中对药房实践提出以下要求[16]:
(1)药房管理者应确保非处方药摆放区域与药品目录分类规定中的区域一致;
(2)药师应尊重患者的隐私权和保密权;
(3)当患者咨询第Ⅱ类或第Ⅲ类药品时,药师在提供建议之前应收集信息以评估患者的认知水平和需求;
(4)药师在推荐第Ⅱ类、第Ⅲ类或未分类药品时,应采取必要措施以履行其职责;
(5)若药师认为合适或必要,药师应将与患者的互动交流记录在患者档案上。
5、启示与借鉴
加拿大对处方药与非处方药的分类管理,无论是制度安排、配备政策、标准体系还是具体管理机制,都是比较系统和完整的。相关的管理政策、机制和标准,对我国正在进行的《处方药与非处方药的分类管理办法》修订和药品分类管理制度完善都具有一定借鉴意义。
5.1 完善药品分类管理法律法规和配套政策
2001年我国《药品管理法》规定“国家对药品实行处方药与非处方药分类管理制度,具体办法由国务院制定”,但在接下来很长一段时间,该办法一直未制定。2019年《药品管理法》修订,规定“国家对药品实行处方药与非处方药分类管理制度,具体办法由国务院药品监督管理部门会同国务院卫生健康主管部门制定”。目前实行药品分类管理的依据是1999年7月国家药品监督管理局颁布的《处方药与非处方药分类管理办法(试行)》,距今已有20多年,故亟待根据药品监管新形势和新法规做出修订和完善。处方药与非处方药分类管理制度,涉及卫生健康、市场监管、药品监督管理、中医药、医疗保险、商务部门等各个政府部门的职能,涉及医药产业的发展水平和药品供应保障的质量和水平,是一项社会系统工程。另外,目前国务院正在修订《药品管理法实施条例》,国家市场监督管理总局正在制定部门规章《药品经营和使用质量监督管理办法》,这些都对经营处方药、甲类非处方药和乙类非处方药有具体条文规定。这2个法规对药品分类管理法规体系建设具有重要的基础价值,但从当前发布的征求意见稿来看,其并未对药品分类管理做出新的制度安排,还只是原有条文的沿袭。笔者建议《药品管理法实施条例》《药品经营和使用质量监督管理办法》及后续国务院药品监督管理部门会同国务院卫生健康主管部门制定的处方药与非处方药分类管理办法,能从“患者为中心”和完善药品供应保障制度的更高层次,对处方药与非处方药分类管理设计出更加精细和系统的制度安排,为保障公众用药安全、有效、可及提供系统的法律法规依据。
5.2 加强处方药和非处方药的精细化分类管理
相对非处方药,处方药的使用专业性更强,因此处方药须凭医师处方才可调配、购买和使用。非处方药具备药品和普通消费品的特性,其身份的确定较为严格。我国目前的药品分类管理采用排除法,即遴选入国家非处方药目录的为非处方药,其余药品均按照处方药进行管理。这种管理方式虽然较好地保证了非处方药的安全性,但不符合风险管理的原则,因为精准管理思维应是对需要严格管理的处方药和部分需要特别关注的非处方药制定目录。现阶段我国药品零售企业中,处方药未凭处方销售问题比较突出,其中的部分原因是处方药与非处方药管理缺乏系统安排,处方药管理缺乏细化标准,非处方药总体品种还不能充分满足公众用药需求。
笔者建议,可参考加拿大药品分类管理的模式,改粗放式管理为精准管理,进一步细化处方药与非处方药分类标准,将药品分为处方药和3类非处方药,并分别明确目录。具体方案包括以下3个方面:
(1)将目前分类管理政策中已经明确的“注射剂、医疗用毒性药品、二类精神药品、九大类药店不得经营的药品以外其他按兴奋剂管理的药品、精神障碍治疗药(抗精神病、抗焦虑、抗躁狂、抗抑郁药)、抗病毒药(逆转录酶抑制剂和蛋白酶抑制剂)、肿瘤治疗药、含麻醉药品的复方口服溶液和曲马多制剂、未列入非处方药目录的抗菌药和激素”先行确定为必须凭处方销售的药品;
(2)对其他处方药,再采取级联原则进行再评价和转换,将实践中常用的、风险性较低的、符合特定条件的部分处方药调整为类似于加拿大第Ⅱ类药品的甲类非处方药,设置合理的非处方药转换注册程序;
(3)对当前的甲类非处方药和乙类非处方药进一步调整为3类,分别是柜台后面的甲类非处方药、可开架销售的乙类非处方药和在超市、零售店都能销售的一般销售清单药品。通过细分和采用处方药目录与非处方药目录的形式,使所有药品品种都有一个明确的分类管理属性,并将所有目录供公众查询,让公众和从业人员都有统一标准来执行,以更好地满足患者的自我药疗需求和非处方药的发展。
5.3 完善药品分类注册和转换审查标准
2019年我国《药品注册管理办法》规定处方药和非处方药实行分类注册和转换管理;国家药品监督管理局药品审评中心根据非处方药的特点,制定非处方药上市注册相关技术指导原则和程序,并向社会公布;药品评价中心制定处方药和非处方药上市后转换相关技术要求和程序,并向社会公布。为此,笔者建议:
(1)加强处方药、非处方药的精细化分类管理,通过引导企业参与药品上市后评价,指导企业开展非处方药的分类注册和转换管理,同时制定具有指导性的制度规则和行业指导原则,为药品上市许可持有人申请注册和转换提供明确的指导和要求。
(2)可参考加拿大非处方药分类审查要素,明确和细化我国非处方药分类标准,适当简化非处方药注册程序。
(3)完善配套政策体系,制定指导企业开展非处方药研发的分类管理指南,引导和鼓励非处方药的申请和创新,促进制药行业的发展。另外,加拿大对“传统药物”及“顺势疗法药物”建立了一套特殊的管理模式,这种模式虽然不适用于我国,但是对于传统中药的管理有一定的借鉴价值。我国不能完全参照化学药类非处方药的模式管理中药非处方药,药品监管部门可建立和发布中药非处方药规范化技术标准或指导性文件,以更好地指导企业研发和生产中药类非处方药产品,同时充分考虑中药类非处方药在注册和转换中的特殊性,支持和发展我国中药类非处方药,为中药国际化竞争创造优势。











