一到年底就会发现,看文章的速度根本赶不上大神们发文章的速度,昨天又看到JNS上一篇Mayo Clinic的教授们,与Michigan Technological University,以及Fort Wayne Metals的老师们,共同发表的“Benchtop proof of concept and comparison of iron- and magnesium-based bioresorbable flow diverters”一文,趁热打铁一起来讲一下吧。
图1 最新发表在JNS上的这篇,铁基和镁基生物可吸收血流导向装置的台式设计验证和比较
血流导向装置(Flow diverters,FDs)相信大家都无比熟悉了,由于永久金属植入物的血栓栓塞、慢性炎症、载瘤动脉狭窄以及相邻血管闭塞等问题,很多研究者认为生物可吸收血流导向装置(Bioresorbable FDs,BRFDs)将是下一代FD的技术方向,尤其是基于冠脉可吸收支架领域的广泛研究。本文伊始,研究者们就开宗明义表示,生物可吸收金属具有更高的机械强度和刚度,以及高延展性和生物相容性,使其作为血管支架优于聚合物材料。据此,他们开发了本文中的金属BRFDs,分别采用镁基(MgBRFD)和铁基(FeBRFD)合金,并比较了其孔隙率/孔密度、径向强度、体外血流导向功能和吸收动力学。
研究者们制作了直径均为4.75mm的BRFD原型,这其中由于镁合金丝的预期硬度和刚度较低,且吸收速度较快,因此镁合金丝的直径更大。又由于制作过程中的几何限制,较大的丝径需要减少线圈数。是故,MgBRFD包含32根以大约60°编织的金属丝,在这32根线材中,24根为生物可吸收镁合金WE22(Fort Wayne Metals),直径为50um,含有>95%的镁,其余成分为稀土元素。剩余8根线材由钽(Ta)组成,直径为30um,涂有40um的聚酰亚胺,可提供介入术中的不透视性,并防止Mg-Ta交界处的电偶腐蚀。对比而言,FeBRFD包含48根金属丝,同样以大约60°编织,其中36根由非铁磁生物可吸收铁合金FeMnN组成(惊现,MRI兼容性材料),直径25um,除铁以外含有35%的锰(Mn)和0.15%的氮(N)。其余12根线材类似MgBRFD,由聚酰亚胺涂层的Ta组成。
图2 左图,MgBRFD和FeBRFD的大体图像,黑色条代表2mm。右图为立体显微镜(Leica MZ 125)下拍摄的,用于计算孔隙率和孔密度的*4倍放大图像,黑色条代表1mm
测量结果显示,MgBRFDs和FeBRFDs的孔隙率分别为81%和79%,MgBRFDs和FeBRFDs的孔密度分别为4.3孔/mm2和9.9孔/mm2。两个装置的编织角均为64°。(这里,大家可以回忆下经典PED的参数分别是多少~)
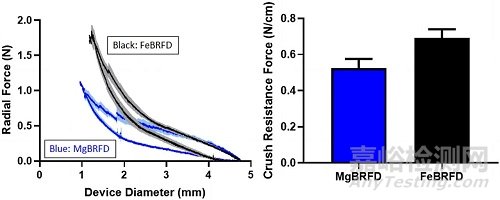
在抗压测试中,研究者们将两款装置切割为10mm长,放置在线性运动平台的两个平行板间,固定其中一块板,另一块板则以0.1mm/s的速度平移,将导向装置逐渐由初始直径压至约1mm,随后,移动的平板再匀速返回初始位置。如下图3,结果显示径向力与BRFD直径的关系均呈滞后性,与再膨胀期间施加到平板上的力相比,在抵抗挤压过程中两个装置都表现出了更高的力,这也是血管内金属器械的典型表现。MgBRFD和FeBRFD的抗压强度分别为0.53±0.05N/cm和0.69±0.05N/cm,差异没有统计学意义(p=0.0765,每组n=3),且都在FDA批准FD既往所报告的0.31-1.15N/cm的范围内。
图3 抗压测试结果,左图,对MgBRFD和FeBRFD所施加的力与装置直径间的关系,实线和较浅的阴影代表平均值±标准差;右图,MgBRFD和FeBRFD的抗压强度
体外血流导向测试中,研究者们将两款装置切割为15mm长,部署于3D打印的侧壁动脉瘤模型中,其载瘤血管内径为4.5mm,动脉瘤瘤颈5.2mm,瘤体宽度和高度均为8mm。载瘤血管围绕10mm半径弯曲160°,动脉瘤位于弯曲部的顶点。随后,将模型连接蠕动泵,以4.5ml/s的平均流速泵水。采用电动注射器以4ml/s的速度注射6ml造影剂,Artis(Siemens)系统负责记录。结果如下图4,定性分析显示两者释放后,造影剂进入瘤内似乎没有差异;然而,定量分析显示,FeBRFD组动脉瘤内造影剂的停滞时间更长,造影剂渗出瘤体减少,导向作用更强。
图4 左图,MgBRFD和FeBRFD的归一化时间密度曲线,实线和较浅的阴影同样代表了平均值±标准差;右图,MgBRFD和FeBRFD的造影剂平均通过时间MTT、进瘤斜率WIS-1和出瘤斜率WOS-1的比较,其中MTT和WOS-1两组间有统计学差异,提示FeBRFD的血流导向功能更好
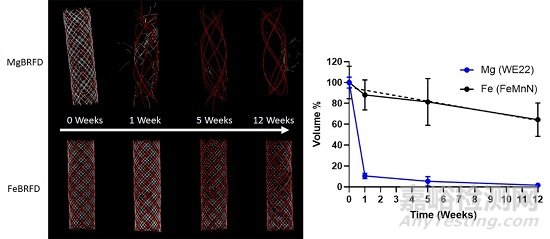
而在体外吸收分析前,研究者们先将FeBRFD在15%柠檬酸中超声处理5分钟,去离子水中超声处理3分钟,然后在无水乙醇中超声处理1分钟,以去除薄的氧化表面层。随后将两款装置切割成10mm长度后,部署在另一个3D打印侧壁动脉瘤模型中,其载瘤血管内径为4mm,动脉瘤瘤颈为4mm,高度和宽度均为8mm。在37℃的培养箱中,将模型连接蠕动泵,以0.5ml/s的速度泵送Dulbecco改良的Eagle培养基(DMEM),并每3天更换一次。最终,显微CT分析的3D渲染图如下,结果显示镁合金丝在1周发生大量吸收,使其几何编织的结构几乎丧失,5周时基本完全被吸收。与之相对,铁合金丝的吸收要慢得多,12周时仍能保持住原有结构。铁合金丝的体积随时间减少,其线性回归具有统计学显著性(R2=0.934,p=0.034),预估其大约在36周时可完全被吸收。(注意,这个体外测试与体内情况最不同的一点是,当处于体内环境时,血管内植入装置表面很快会被血液蛋白和新生内膜覆盖,从而显著降低了其吸收的速率。但毕竟当前神经介入领域理想的吸收速度尚未确定,仍可不断探索)
图5 左图,随着时间的推移,MgBRFD和FeBRFD的代表性显微CT 3D渲染图,其中红色代表钽Ta,白色代表生物可吸收金属丝;右图,随时间推移,两种装置中生物可吸收丝体积的减少曲线
因此,在讨论部分研究者们指出,铁合金具有更高的强度和更慢的吸收速率,使其能用于制造丝径仅为25um的FeBRFD,并在制作过程中将更多的金属丝纳入,从而提高导向装置的孔隙密度并优化其分流功能。此外,吸收分析中的FeBRFD能保持其编织结构12周以上,因此,铁合金是BRFD应用的优质材料。下一步,他们将继续研究FeBRFD的体内吸收率,并同时使用动物模型评估其各项性能。
在评价聚合物BRFD的同类时,研究者们也补充了既往的一些临床证据,聚合物BRFD需要球囊血管成形术释放(除非掺杂金属丝),且动物试验显示动脉瘤颈部的聚合物丝会出现偏心形分布,使得动脉瘤闭塞率降低。同时,聚合物相对于金属的机械强度较差,使得聚合物BRFD的丝径固定在40-50um间,无法达到更细。
引用文献:
1. Alexander A. Oliver, Cem Bilgin, Andrew J. Vercnocki, et al. Benchtop proof of concept and comparison of iron- and magnesium-based bioresorbable flow diverters. DOI link: https://doi.org/10.3171/2022.11.JNS222213.