您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-08-19 23:36
一、医疗器械临床试验的主要内容
医疗器械临床试验的目的是评价受试产品是否具有预期的安全性和有效性。由于临床试验通常是根据研究的目的,通过样本来研究器械对疾病及其预后等方面的作用,而一个好的医疗器械临床试验应能够提供最客观的安全性和有效性评价。因此,医疗器械临床试验设计必须应用统计学原理对试验相关的因素做出合理的、有效的安排,并最大限度地控制试验误差,提高试验质量,并对试验结果进行科学合理的分析,在保证试验结果科学、准确、可信的同时,尽可能做到高效、快速、经济。因此,生物统计学在医疗器械临床试验的全过程中有着不可缺少的重要作用,只有当研究结果既具有临床意义,又具有统计学意义时,该器械才能获得批准。
二、试验设计类型
特别强调的一点是,由某个研究者造成的背离研究方案将对试验的分析产生巨大的问题。申办者应保证研究者遵从研究方案。有迹象表明,在试验过程中不愿遵从方案的研究者,不论何种原因都不能参与临床试验。医疗器械临床试验的设计分为四种类型:平行组设计,交叉设计,析因设计和目标值法的单组设计。
1.平行组设计
平行组设计也就是人们常说的头对头设计,即试验组和对照组同时开始、同时结束,是所有试验设计中最简单、也是最常见的—种试验设计类型。平行组设计中,各组受试者在试验中处于相同的条件,唯一的不同点是各组所使用的器械不同,如有的是试验器械,有的是对照器械,最后根据试验结果作出统计分析。通常,根据试验方案的需要,可为试验组设置一个或多个对照组,试验器械也可按照若干种治疗强度设组。对照器械的选择应符合试验方案的要求。下面通过案例分析来了解一下平行组设计:
【例2-1】假设某临床试验采用多中心、单盲、随机对照方法,验证西罗莫司(雷帕霉素)可降解涂层钴铬合金冠脉药物洗脱支架系统的有效性和安全性,对照组为已上市的其他品牌西罗莫司(非降解涂层)药物洗脱支架。按照入选和排除标准选取合适患者参加本次验证,对所有入选患者在270d(土30d)时进行造影随访,以标准的定量冠状动脉造影(QCA)评测获得的支架内晚期管腔丢失水平作为主要疗效指标,以评价试验产品的有效性,同时将随访过程中的主要心脏不良事件(MACE)作为安全性指标进行评价。
【例2-1分析】本研究是一个平行组设计的试验,通过随机化的方式进行分组,试验器械为某一“西罗莫司可降解涂层钴铬合金冠脉药物洗脱支架系统”,对照器械则是“西罗莫司《非降解涂层)药物洗脱支架”,其考虑为:对于药物洗脱支架,平台、涂层和药物是核心要素,在该研究开展时尚无可降解涂层产品获得批准,故选择的对照组为非降解涂层,但金属平台和药物均与待验证的试验支架相同(即所谓的同类产品)。主要终点主要根据 CFDA 发布的指导原则,通过定量冠状动脉造影(QCA)获得替代终点结果,并最终对产品的安全有效性进行评价。
2.交叉设计
交叉设计是按事先设计好的试验次序,在各个时期对受试者逐一实施各种处理,以比较各处理组间的差异。交叉设计是将自身比较和组间比较设计思路综合应用的一种设计方法,可以很好地控制个体间的差异,同时减少受试者人数。然而,实施交叉设计比实施平行设计更复杂,因此需要更密切的试验监查。每个试验阶段的治疗对后一阶段的延滞作用称为延滞效应。采用交叉设计时应避免延滞效应,即在每个试验阶段后需安排足够长的洗脱期或有效的洗脱手段,以消除第一阶段试验所产生的延滞效应。
最简单的是二阶段交叉设计(2*2交叉设计),对每个受试者安排2个试验阶段,分别接受2种器械治疗,而每一受试者在第一阶段接受何种器械是随机确定的,第二阶段必须接受与第一阶段不同的另一种试验用器械。因此,对于2*2交叉设计,每个受试者均需经历如下几个试验过程,即准备阶段、第一试验阶段、洗脱期和第二试验阶段。在两个试验阶段分别观察两种试验用器械的疗效和安全性。下面通过案例分析来了解一下2*2交叉设计:
【例2-2】假设有A,B两种闪烁液分别测定血浆中的3H-cGMP水平(A为试验产品、B
为对照)。第一阶段1,3,4,7,9号受试者用A液测定,2,5,6,8,10号用B液测定;第二阶段1,3,4,7,9号用B液测定,2,5,6,8,10号用A液测定。试比较A,B两种闪烁液测定结果之间的差别有无统计学意义(表2-1)。
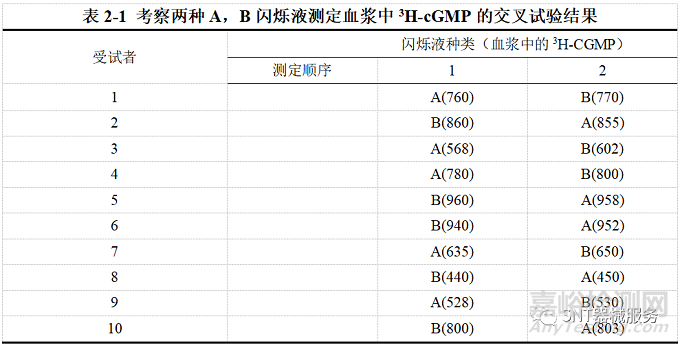
【例2-2分析】本例中的一个试验因素(干预方法)是“闪烁液”,有A,B两个水平;两个区组因素分别是测定顺序和受试者号;观测的定量指标为“血浆中的3H-CGMP”。在研究过程中,是对从受试对象获得的样本进行直接检测、故延迟效应的影响相对较小。由于两种处理在同一对受试对象之间施加的顺序是交叉进行的。故为二阶段交叉设计(2*2交叉设计)。
3.析因设计
可应用于医疗器械临床试验的第三种设计是析因设计。当一个医疗器械一个治疗(如药物治疗)相比较时,经常使用这种方法。这种研究设计可回答如下问题:是否器械独自起作用?或是否器械与药物治疗相互影响,联合产生更强的作用?本设计的不足之处是实施起来更复杂,因此申办者必须保证研究者严格按照研究方案实施临床试验。
析因设计也许需要更大的样本量,但是由于这种设计类型基本上是两个临床试验合并成一个,因此效率更高。但是,如果试验的样本量是基于检验主效应计算的,则估计器械与药物的交互作用时会使检验效能降低。下面通过案例分析来了解一下析因设计:
【例2-3】某临床试验预研究人工水球、及某中成药对于肥胖患者的治疗效果,在器械比较中试验组使用新的人工水球(A),对照组使用常规人工水球(B);同时对药物进行的比较则为试验组是被试中药、对照组为安慰剂,希望观察到器械和药物分别的作用,并考察试验因素间(不同人工水球与不同药物)可能存在的交互作用,故选择析因设计,资料如表2-2
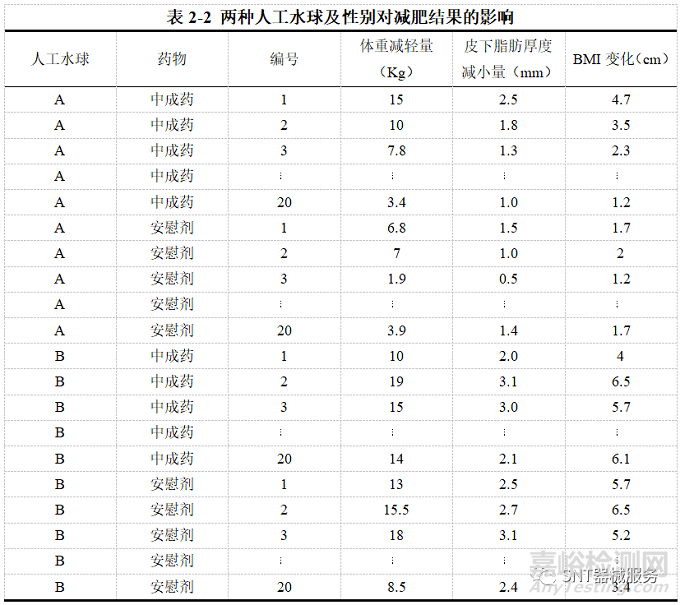
【例2-3分析】本研究除了考察两种人工水球对减肥患者疗效的差别,同时还检验中成药的使用是否对于减肥效果有影响的,受试者相当于被随机分配到4种可能的分组之一,除比较人工水球和中成药效果外、还可考察两者的交互作用,因此该临床试验设计可以认为是析因设计。
4.目标值法的单组设计
对于某些器械,如果存在本研究领域临床认可的、国内/国外公认的疗效/安全性评价标准(如FDA/SFDA指导原则、ISO标准、国标或部标等规范或指南),其中明确指出了该器械的主要疗效/安全性评价指标及其评价标准,那么可以以此评价标准为目标值计算临床试验样本量,并进行符合该目标值的单组试验。试验结果的评价,同样应采用主要疗效评价指标的95%可信区间。这种与目标值进行比较的单组试验,称作OPC(optimal performance criteria)研究。
原则上,不建议采用单组试验的设计方式,因为目标值对照属于外部对照的特殊形式,故该设计方式存在外部对照试验的所有缺陷,当前的目标人群(所设定入排标准对应的),可能与目标值制定时的基础人群存在差异、治疗的技术与评价方式亦可能存在区别,故导致可比性及结论的可靠性降低。而且,目标值设计的前提应该为所验证器械属于低风险且成熟的产品,此时方能通过已经发表和累计的大量临床证据中提取并制定出合理的目标值。对全新产品,以“无同类产品”作为使用单组试验设计的理由是不充分的,此时最合理的试验设计方式应为与“现有标准治疗“进行比较的随机对照试验,因为在无同类产品的情况下,也就不存在制定比较标准(目标值)的可能性了。

来源:SNT器械服务


