您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2022-05-20 14:38
药物治疗是心衰治疗的基石。心衰的药物治疗近几年发展迅速,几种重要的新药已经成功推向市场并得到了广泛应用,但只有少数的心衰治疗器械得到了FDA批准。虽然药物治疗降低了心衰死亡率和住院率,但药物治疗无法真正阻挡心衰进程和解决重大残余风险。许多心衰患者生活质量仍然较差。因此,基于器械的心衰治疗仍存在较大空间。
2022年2月1日至2日在纽约举办了首届“心衰治疗技术大会”。会议回顾了基于药物和器械的最新疗法,并讨论了心衰的诊断、管理策略和未来的疗法。本次心力衰竭治疗会议的亮点之一是“Shark-Tank”创新竞赛,7家初创公司展示了他们的对于心衰器械治疗的最新尝试。
01Audicor远程病人监护系统
根据指南指导的药物治疗调整和心衰再住院预防是心衰患者管理的关键目标。心衰患者的远程监控为医生和患者提供了解决这两个问题的机会。在COVID-19世界范围大流行的今天,慢性心衰病人的远程居家监控得到广泛关注。目前,临床上使用的心衰病人远程管理设备如CardioMEMS和Boston Scientific HeartLogic等,虽然对心衰患者再住院预防起到积极作用,但由于其价格昂贵而且有创,并未得到广泛使用。
Audicor RPM是一种用于远程心衰患者监测的无创系统,可在家中使用。Audicor RPM最近获得FDA“突破性医疗器械”的认定。心脏声学生物标志物(CAB)通过大型临床数据库上开发的机器学习算法,从数十个同时记录的心电图和心音数据中自动生成。Audicor RPM的心衰管理就是基于此类心脏声学生物标志物,最相关标志物如心脏电-机械激动时间(EMAT,QRS波起点至第一心音峰强度点)和第三心音(S3)强度。EAMT在左心室收缩功能受损患者中延长,并与左室内压变化速率相关。当EAMT比例超过心动周期(EMATc)>15%时,与左室功能障碍显著相关[1]。S3是心力衰竭伴呼吸困难恶化的特异性标志物,也是不良临床结果(如心力衰竭进展)的独立预测因子[2]。
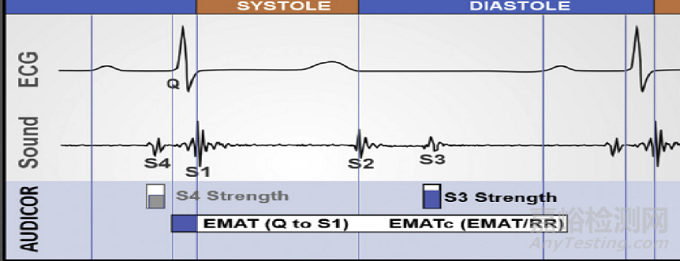
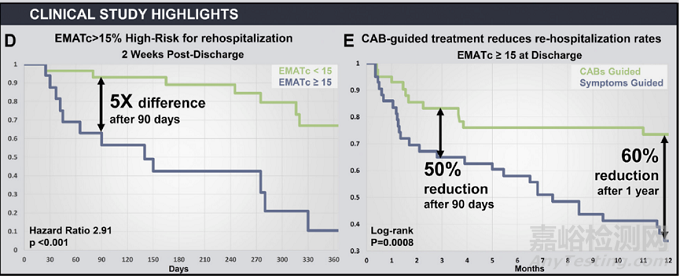
最近的一项随机对照实验显示[3],基于Audicor EMAT和S3指导的心衰管理与基于症状的心衰管理相比,Audicor指导下的患者主要终点事件减少(43:61,P<0.001)。
新型的Audicor RPM是一种手持设备,与之前的Audicor设备使用相同的商用算法和等效信号采集技术,从胸部(V4)的单个位置获取心脏声学和电信号。该设备可连接到互联网进行Audicor云分析,产生供临床医生查看的CAB趋势,并根据固定测量阈值自动发出心衰失代偿风险警报。阈值可以根据每位患者的心音个体化设置。心衰恶化的早期识别可以及时对药物进行干预和调整,从而防止再次入院。
02用于优化心力衰竭管理的新型无创
生物传感器和人工智能算法
心衰患者的血流动力学监测对心衰患者管理具有重要地位,但临床标准侧重于患者症状,难以识别以心内充盈压升高(如肺毛细血管楔压)为特征的无症状血流动力学充血。
迄今为止,FDA批准用于心衰患者门诊血流动力学监测的设备只有1种。虽然该设备可以降低心衰患者住院率,但由于其价格昂贵和永久性的有创植入只有极少部分患者使用该设备[4]。
Cardiosense,Inc公司正在开发一种无创心脏监测平台。该平台通过分析由可穿戴设备CardioTag捕获的心电图和光电容积脉搏波信号,以无创估计血流动力学参数,主要侧重评估PCWP的变化。Cardiosense检测平台获得FDA“突破性医疗器械”认定,并用于LVEF<40%的NYHA Ⅲ或Ⅳ级患者居家无创测量PCWP。
在20名心衰患者的概念验证研究中,每位患者在接受右心导管介入和血管扩张剂的情况下分析CardioTag的有效性。CardioTag在右心导管介入和血管扩张剂激发期间获得信号,通过分析CardioTag信号改变,建立回归模型估计PCWP变化。结果发现回归模型可以准确估计PCWP变化(均方根误差=2.9mmHg;R2=0.95)[5]。
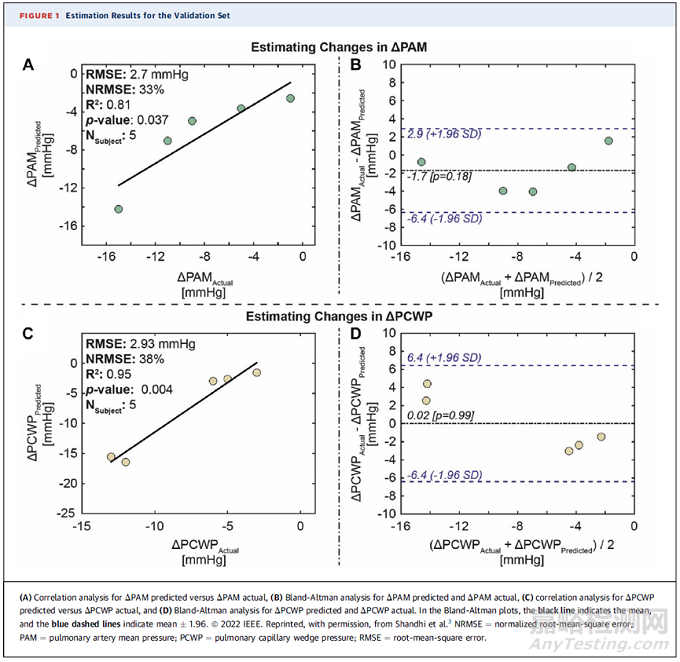
Cardiosense监测平台由CardioTag和机器学习技术组成,为心衰的血流动力学监测提供了无创的选择,未来可以更广泛的应用于心衰人群中。
03永久性右侧内脏神经消融术
心衰患者血容量调节能力受损。特别在运动时,交感神经的兴奋促进血液重分布,增加循环血容量,即使微弱的改变,也可能促进心衰患者肺和左侧心脏充盈压力的突然升高,引起相应运动不耐受症状。改善左侧心脏充盈压力可提升心衰患者的运动能力、生活质量,并降低相关心血管疾病发病率。
外周血管床和中央血管床之间的血液流动是左侧充盈压力改变的主要因素。内脏血管床是外周血管床的重要组分,具有高度顺应性。临床前研究和临床研究均支持交感神经系统可通过调节内脏大神经影响内脏床的容量和顺应性。心衰时,内脏大神经刺激导致心脏前负荷和中心血管压力迅速增加[6]。目前的临床研究证实,阻断内脏大神经可以降低PCWP,改善患者心输出量和运动能力[7, 8]。永久性的消融内脏大神经在顽固性腹痛患者中具有良好的耐受性和长期安全性。
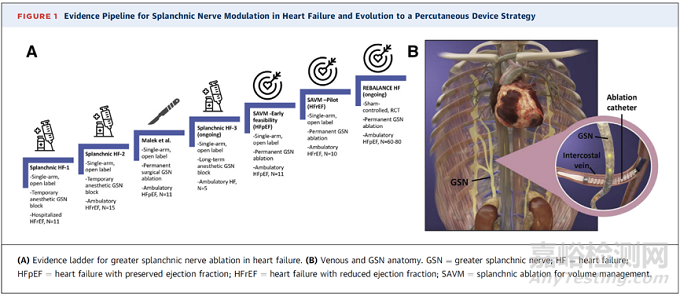
根据这些理论,研究者新开发出一种微创、经静脉、永久性去除右侧内脏大神经的手术。这项手术主要用于容量管理治疗,相关试验正在进行中。试验招募了11名HFpEF患者,这些患者NYHA分级为Ⅱ或Ⅲ级,LVEF≥50%,静息时PCWP升高15mmHg或运动时PCWP升高25mmHg。Axon消融系统临时部署在右侧GSN附近的血管内为导管提供射频能量(右股静脉进入上腔静脉,并通过奇静脉逆行进入第10和第11胸椎水平)。患者在基线以及干预后1个月、3个月、6个月和12个月接受评估。迄今为止的累积证据支持内脏大神经消融的安全性和有效性。
04可植入同步膈肌刺激治疗系统
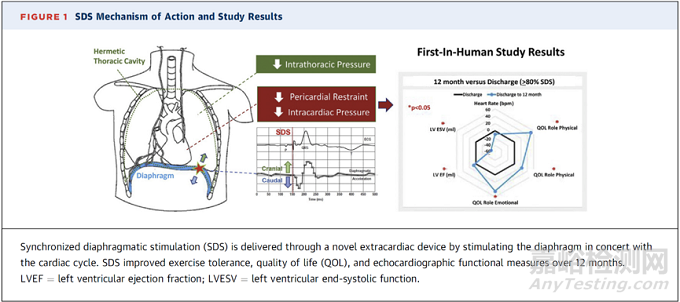
心脏再同步化治疗指征要求较高,对于部分应用指南药物最大耐受剂量仍存在心衰症状的患者,亟需器械辅助改善患者症状,提升这部分患者生存质量[9]。同步膈肌刺激(SDS)被FDA认定为“突破性医疗器械”,可以改善有症状的HFrEF患者心脏功能、症状和最终临床结果。
心内压升高是心力衰竭的标志,也是疾病进展和运动能力受限的关键病理因素。心脏压力升高的程度取决于前负荷、后负荷和心包约束。心包约束心脏,约束程度由心包结构本身和胸内压决定。SDS通过刺激膈肌收缩调节胸内压时间变化,减少心包约束,从而改善心脏充盈并减少后负荷。在心动周期正确时间刺激膈肌后 ,可以同步改善心脏充盈和心脏收缩性能。此外,由于刺激的是Ⅰ型膈肌纤维,相应的膈肌“抽搐”虽然可能会产生临床影响,但并不影响患者呼吸,患者也感知不到[10, 11]。
临床前研究和临床研究已经验证SDS理念。一项小型随机交叉试验证实,与单独的CRT治疗相比,3周的膈肌起搏改善了患者的呼吸困难、运动能力和左心室射血分数(LVEF),并且LVEF的改善持续长达1年[12]。
目前开发出一种可植入的SDS治疗系统,该系统通过微创植入可在门诊完成。该系统由一个可植入的脉冲发生器、适用于膈下放置的刺激/传感导线和一个定制的手术输送工具组成,整个过程通过腹腔镜手术完成。SDS治疗系统的的首次人体实验招募了15名有HFrEF症状、NYHA Ⅱ/Ⅲ级和缺血性心脏病的男性。12个月的随访中,所有患者均有显著改善,没有发生植入程序或SDS相关的不良事件,患者没有感觉到持续的膈肌刺激。在80%同步水平的SDS治疗亚组中,LVEF变化具有统计学意义(中位数:28% [IQR:23%-40%] vs 34% [IQR:34%-38%]; P=0.005)。
令人鼓舞的临床前和首次人类研究结果表明,SDS 是一种很有前景的新型长期治疗概念,但后续需要在随机临床试验中得到验证。
05心肺神经刺激系统
目前针对急性失代偿性心力衰竭的治疗方法几十年来一直保持不变,并且在患者安全和临床有效性方面存在局限性。心血管系统富含交感神经和副交感神经纤维。动物实验提示在靠近心脏的地方激活这些神经可以产生局部效应,不会产生常见的药物如正性肌力药所带来的全身性后果[13, 14]。
心肺神经刺激(CPNSTM)系统(Cardionomic,Inc)是一种基于导管的研究设备,旨在电刺激右肺动脉(RPA)周围的心脏自主神经。CPNS系统使用临时经皮装置可改善心脏功能,增加全身灌注。
CN2导管使用标准的右心导管介入技术和透视引导通过颈内静脉经皮输送到RPA内的目标治疗位置。定位后,CN2导管就会被部署在血管壁上提供相应刺激。基于观察到的生理反应调整电流强度。一旦达到理想的反应,该系统可以保持原位并提供长达5天的治疗。最初的单中心、首次人体概念验证研究发现,患者左室内压变化速率和平均动脉压分别增加了22.6%±4.8%(P=0.006)和13.5%±3.8%(P=0.006)。没有报告严重的不良事件,也没有观察到心率的显着变化。这项研究表明,在心力衰竭患者的心率没有显着变化的情况下,该设备可以增加左室收缩力和动脉血压[15]。随后的新型CPNS2系统研究也同样显示CPNS系统可以在保持安全性的同时增加左室收缩力,对心率产生中性影响。
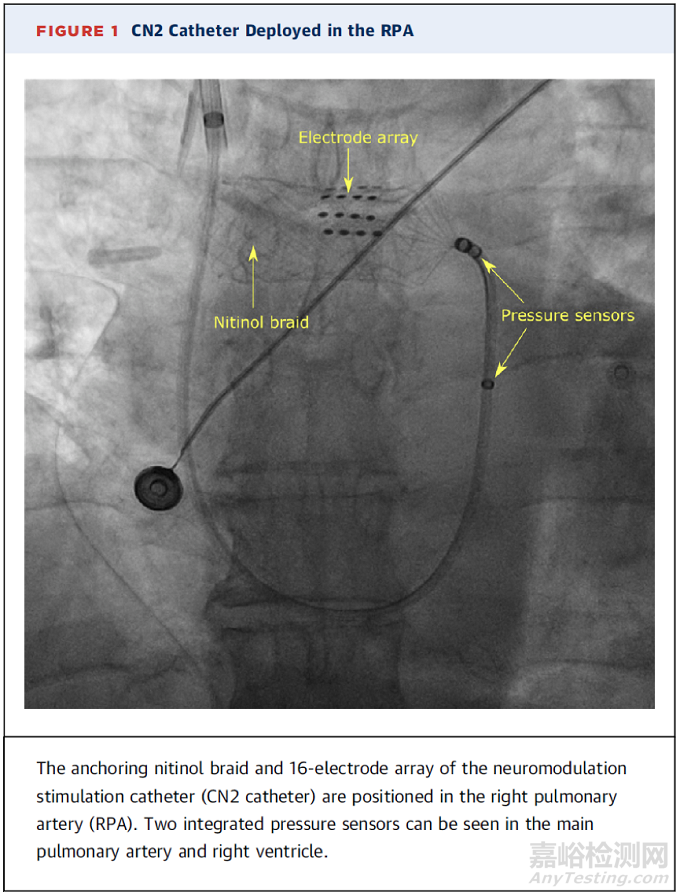
CPNS系统通过刺激位于RPA的心脏自主神经,证明了在不影响心率的情况下增加心脏收缩力的能力。这代表了一种可能使急性失代偿性心力衰竭患者受益的新疗法。
06新型IVC Doraya导管
体液潴留是急性心力衰竭的主要病理生理原因。因此,促进钠和水排泄的利尿剂是一线药物。患者对利尿剂的反应不足是一个主要的临床挑战。因此,一种有效针对容量超负荷和利尿剂抵抗(同时保留肾功能)的干预措施,可能会改善急性心力衰竭患者的预后[16, 17]。
Revamp Medical开发了Doraya导管,作为临时静脉流量调节器,可经皮部署在肾静脉水平以下的下腔静脉(IVC)中。远端框架开口可以调整静脉血液流动,从而减少心脏前负荷和静脉充血。静脉充血被认为是肾功能恶化的重要决定因素,静脉压力过高将导致肾实质缺氧和肾灌注压降低。
最近研究显示Doraya导管可降低急性心衰患者肾脏静脉压。研究纳入标准包括液体超负荷症状、利尿剂反应不足、NT-proBNP≥1600 pg/mL和中心静脉压≥12mmHg。每位患者作为自身对照。共有9名患者接受了导管治疗(7名男性和2名女性患者,平均年龄69±9岁,平均LVEF 24±12%)。利尿率在基线时测量为 77.1±25 mL/h,在器械使用期间测量为 200.8±93 mL/h,同时保持相同的利尿剂剂量。此外,器械使用期间平均峰值尿量为 294±139 mL/h[18]。
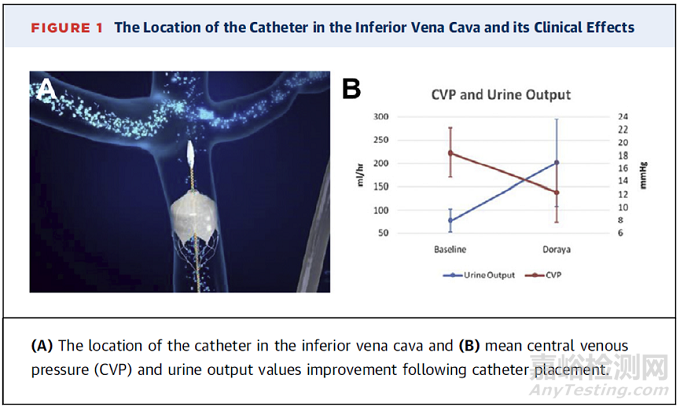
Doraya导管的首次人体研究显示了导管与利尿剂治疗相结合,改变急性心衰患者IVC压力的可行性和安全性。导管产生IVC压力可控下降,平均下降6mmHg,并产生更好的利尿反应。
07用于非卧床NYHA Ⅲ级心衰患者的
无线供电和防水机械循环支持装置
几十年来,晚期心衰患者一直是机械循环支持研究的目标人群。尽管大型耐用血管辅助装置取得了技术进步,但中风、胃肠道出血和动力传动系统感染等严重不良事件的高发生率限制了这些设备的使用[19]。
Second Heart Assist设备(Second Heart Inc)是一个13.5F叶轮驱动泵,可经皮输送到降主动脉。叶轮旋转将血液泵出,可增加高达2.5L的额外脉动流量。该设备通过减少心脏后负荷,达到改善心输出量并降低心脏充盈压力的目的,可为急性失代偿性心衰并出现显著利尿剂抵抗的患者提供24小时支持。
第二代 SHA Freedom设备(Second Heart Inc)提供完全无线供电。电源只有手机大小,装在完全防水的轻质背心口袋里。接收器线圈可以存储足够的电力供患者选择性地脱下背心并在没有附件的情况下淋浴,并且允许患者进入长达30m的任何水体。这在机械辅助装置领域是巨大进步,极大地提升了患者生活质量。该无线设备可提供72小时不间断电源,并且易于充电、支持蓝牙。此外,该设备可作为部分支持泵,以低至2,000-3,000转/分钟的速度运行,满足个别患者的支持需求。它适用于从数周到数月或更长时间的长期循环支持,如心衰住院后的危险期,以及移植前桥接支持等。

这种无线供电的机械循环支持设备,为不能卧床的晚期心衰患者心脏和肾脏提供重要支持,并且对这些患者的生活质量提供前所未有的改善。长期目标是减少住院次数、改善容量和利尿剂管理,并延缓心衰时心脏和肾脏功能的衰退,从而降低护理成本。
上述7种心衰治疗设备的新尝试,展示了这7个初创公司对心衰器械治疗的不懈探索,为世界范围内的心衰器械创新者们提供了新的思路。虽然针对的只是相对较小和某些特定心衰患者亚群,但解决这些心衰患者的临床需求,提升他们的生活质量,是一代代心衰器械创新者们共同的追求。
[1] <Performance of phonoelectrocardiographic left ventricular systolic time intervals and B-type natriuretic peptide levels in the diagnosis of left ventricular dysfunction.pdf> [J].
[2] <safety of early hospital discharge following admission with st-elevation myocardial infarction treated percutaneous coronar>科研通-ablesci.com).pdf> [J].
[3] SUNG S H, HUANG C J, CHENG H M, et al. Effect of Acoustic Cardiography-guided Management on 1-year Outcomes in Patients With Acute Heart Failure [J]. J Card Fail, 2020, 26(2): 142-50.
[4] SINGH R, VARJABEDIAN L, KASPAR G, et al. CardioMEMS in a Busy Cardiology Practice: Less than Optimal Implementation of a Valuable Tool to Reduce Heart Failure Readmissions [J]. Cardiol Res Pract, 2018, 2018(4918757.
[5] SHANDHI M M H, FAN J, HELLER J, et al. Estimation of Changes in Intracardiac Hemodynamics Using Wearable Seismocardiography and Machine Learning in Patients with Heart Failure: A Feasibility Study [J]. IEEE Trans Biomed Eng, 2022, PP(
[6] BAPNA A, ADIN C, ENGELMAN Z J, et al. Increasing Blood Pressure by Greater Splanchnic Nerve Stimulation: a Feasibility Study [J]. J Cardiovasc Transl Res, 2020, 13(4): 509-18.
[7] FUDIM M, GANESH A, GREEN C, et al. Splanchnic nerve block for decompensated chronic heart failure: splanchnic-HF [J]. Eur Heart J, 2018, 39(48): 4255-6.
[8] FUDIM M, BOORTZ-MARX R L, GANESH A, et al. Splanchnic Nerve Block for Chronic Heart Failure [J]. JACC Heart Fail, 2020, 8(9): 742-52.
[9] FUDIM M, ABRAHAM W T, VON BARDELEBEN R S, et al. Device Therapy in Chronic Heart Failure: JACC State-of-the-Art Review [J]. J Am Coll Cardiol, 2021, 78(9): 931-56.
[10] BEELER R, SCHOENENBERGER A W, BAUER P, et al. Improvement of cardiac function with device-based diaphragmatic stimulation in chronic heart failure patients: the randomized, open-label, crossover Epiphrenic II Pilot Trial [J]. Eur J Heart Fail, 2014, 16(3): 342-9.
[11] ROOS M, KOBZA R, JAMSHIDI P, et al. Improved cardiac performance through pacing-induced diaphragmatic stimulation: a novel electrophysiological approach in heart failure management? [J]. Europace, 2009, 11(2): 191-9.
[12] BEELER R, SCHOENENBERGER A, ZUBER M, et al. Sustained Improvements toVentricular Function Due to Asymptomatic Diaphragmatic Stimulation [J]. Journal of Cardiac Failure, 2017, 23(8):
[13] KOBAYASHI M, SAKURAI S, TAKASEYA T, et al. Effects of Percutaneous Stimulation of Both Sympathetic and Parasympathetic Cardiac Autonomic Nerves on Cardiac Function in Dogs [J]. Innovations, 2012, 7(4): 282-9.
[14] KOBAYASHI M, SAKURAI S, TAKASEYA T, et al. Effect of epivascular cardiac autonomic nerve stimulation on cardiac function [J]. Ann Thorac Surg, 2012, 94(4): 1150-6.
[15] V Y R, PETRU J, MALEK F, et al. Novel Neuromodulation Approach to Improve Left Ventricular Contractility in Heart Failure: A First-in-Human Proof-of-Concept Study [J]. Circ Arrhythm Electrophysiol, 2020, 13(11): e008407.
[16] MULLENS W, ABRAHAMS Z, FRANCIS G S, et al. Importance of venous congestion for worsening of renal function in advanced decompensated heart failure [J]. J Am Coll Cardiol, 2009, 53(7): 589-96.
[17] FELKER G M, ELLISON D H, MULLENS W, et al. Diuretic Therapy for Patients With Heart Failure: JACC State-of-the-Art Review [J]. J Am Coll Cardiol, 2020, 75(10): 1178-95.
[18] DIERCKX R, VANDERHEYDEN M, HEGGERMONT W, et al. Treatment of Diuretic Resistance with a Novel Percutaneous Blood Flow Regulator: Concept and Initial Experience [J]. J Card Fail, 2019, 25(11): 932-4.
[19] KIRKLIN J K, PAGANI F D, KORMOS R L, et al. Eighth annual INTERMACS report: Special focus on framing the impact of adverse events [J]. J Heart Lung Transplant, 2017, 36(10): 1080-6.

来源:CCI心血管医生创新俱乐部


