您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2022-04-14 11:06
Q1、做生物相容性试验时,必须要剪碎样品制备浸提液吗?
答:不是必须剪碎样品,而且是不建议剪碎样品。剪碎样品可能会导致在浸提过程中增加额外的暴露面,且由于物理形态的变化,在部分实验中(细胞、血液等)会造成由于机械原因导致的不良影响,这些都是和临床预期状态不一致的。所以如非必要,不建议剪碎样品浸提。
Q2、短期接触的医疗器械不用做生物相容性是新的标准规定的?
答:根据ISO 10993-1:2018中的描述,某些与机体短期接触的医疗器械非常快速/短暂接触机体(如使用时间小于1min的手术刀、皮下注射针、毛细管),通常不需要生物相容性试验。然而,某些产品的材料,如涂层或润滑剂在器械移除后可能会留在所接触的机体组织内,因此可能需要更详细的生物相容性评定。还宜考虑累积使用时间。
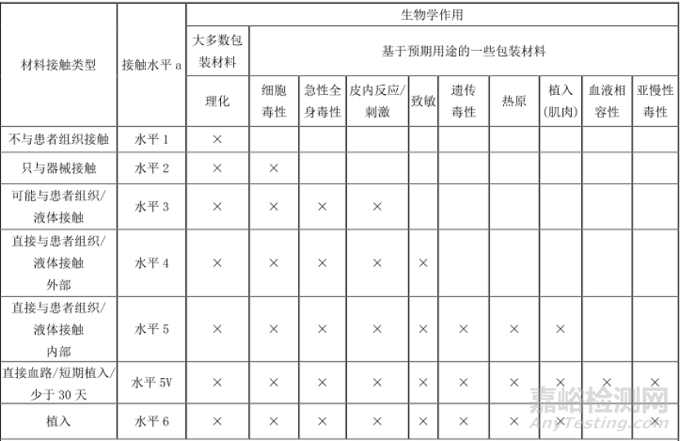
Q3、包装材料的生物学要和产品测试内容一样吗?还是可以减少?
答:ISO 10993-1:2018中首次明确提出对医疗器械包装材料进行生物学评价的考虑。究其原因,与药品包装材料相似,医疗器械包装材料中的可沥滤物,如染料、标签胶也会迁移至医疗器械,然后接触使用者。这边给大家推荐两个标准,T/CAMDI 033-2020以及ASTM F2475-2020。

来源:熠品医疗器械


