您当前的位置:检测资讯 > 法规标准
嘉峪检测网 2021-11-16 22:46
内容摘要:
本文通过对有关医疗器械包装标准和指南的解读,旨在帮助读者为更好开展医疗器械包装的风险管理和生物学评价提供帮助。
关键词:生物相容性 化学表征 评价终点 医疗器械包装 风险管理 生物学评价
医疗器械作为特殊商品,要求其安全、有效[1]。医疗器械包装,尤其是无菌屏障系统,作为器械整体的一部分,同样对其包装材料的生物相容性有着特殊的要求。本文通过对有关法规和指南中相关内容的解读,希望为读者正确理解和进行医疗器械包装的生物相容性评价,提供较全面的参考信息。
01医疗器械包装生物相容性评价的意义
器械包装材料与医疗器械的相容性是许多监管机构的要求。由于多数医疗器械都是与人体直接或者间接接触,可能会产生生物相容性的问题。因此,与医疗器械直接接触的初级(一级)包装材料必须进行评估,以确保它们不会对医疗器械的物理、化学或生物特性产生负面影响,从而保证人体接触和使用的安全性。标准“ISO 11607-1(GB/T 19633.1)材料、无菌屏障系统和包装系统的要求”中明确要求:包装中使用的材料对与之接触的医疗器械无不良影响,并且需要进行生物相容性和毒理学特性的项目评估和考察[2]。此评估可能包括对包装材料相关信息的收集,经验和文献的研究,一系列化学测试和生物测试以及毒理学的安全评估。这种评估也可能会得出这样的结论:如果收集的信息充分,能够证实包装与已上市产品的包装生物等同,或者与设计包装具有相同的安全使用历史,则无需进行测试。因此,包装相容性评价是器械相容性评价有机整体的一部分,对于安全用械有着重要的意义。
02医疗器械包装生物相容性评价的标准和指南
目前, ASTM F2475-20是直接关于医用器械包装材料生物相容性评价的指南[3], 最新版(2020年版)是根据ISO 10993-1:2018[4]原则和理念,对前一版指南(2011年版)在使用范围、术语定义、评价流程以及信息性附录等内容上,进行了全面更新。其中,信息性附录(见表1)根据包装和器械的接触性质和风险分为3类,并给出每类包装需要考察的生物相容性试验项目,对包装和器械生产厂家都有实际的参考意义。其中,对于液体医疗器械的包装归属于高风险类别,需要进行可浸提物和可沥滤物的考察和评估。
表1 信息性的附录---生物相容性试验指南
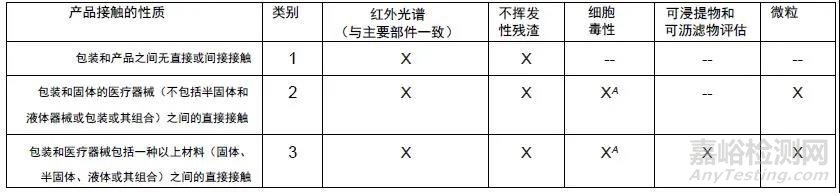
备注:
“X”指相应类别的包装需要考察的生物相容性试验项目;
“XA”指根据医疗器械的风险,其他生物学终点也应在包装的生物相容性评估中进行;
ASTM F2475-20指南只是一个框架性标准,没有包装生物相容性评价的具体实施方案和细则。但是,如果对包装进行了风险评估,则包装材料的生物相容性评价可以参考器械的标准和指南执行。例如,ISO 10993-1 (GB 16886-1) 是针对接触人体的医疗器械生物相容性评估的标准,虽然不直接适用于包装,但其原理和指导思想可以用来包装的生物相容性评价,也满足ISO 11607-1的总体要求。如果需要申报FDA,则可以直接参考FDA CDRH 2020 ISO 10993-1生物相容性使用指南[5]进行评估。此外,如果高风险的包装需要进行可浸提物和可沥滤物评估,可以根据标准《ISO/TS 21726:2019 毒理学关注阈值在医疗器械成分生物相容性评价中的运用》[6]以及ISO 10993-18:2020风险评估过程中的医疗器械材料化学表征[7]等标准进行。如果化学表征的结果需要进行毒理评估,则可以参考ISO 10993-17可沥滤物允许限量的建立[8]等标准进行。
03医疗器械包装生物相容性评价的流程
虽然医疗器械包装只是与患者有间接接触,其生物相容性评估不太可能超过直接或间接接触患者的器械的要求,但由于医疗器械包装种类及形式的多样,人们逐渐认识到,需要根据风险评估的结果,决定是否进行相关的测试以及证明所选测试的合理性,来支持包装材料的安全性。
参考最新的ASTM F2475 -20、ISO10993-1:2018和FDA指南,笔者总结医疗器械包装材料生物相容性评估流程大体如下:
3.1收集有关信息资料
包装材料生物相容性评估和器械类似,优先需要搜集各种资料信息,包括但不限于:材料的牌号、成分组成、加工工艺、使用的加工助剂和添加剂,与器械的接触方式、时间、性质,包装的种类和形式,以及包装和材料的使用历史、文献收录等。信息资料越多越全,风险评估越容易,可能需要的额外测试越少。
3.2进行有关风险评估
根据搜集到各种文献资料信息,对整个最终包装形式进行风险评估。如果现有资料能够证明,包装与已上市产品存在材料等同(物理、化学等同),同时能证明毒理等同,则说明整个包装生物等同;或者经过风险评估,设计包装与已上市产品具有相同的安全使用历史,则无需进行任何测试。如果以上信息不足,则需要根据情况进行适当的进一步研究或者测试,以进一步提供相关信息进行评估。
3.3选择有关测试项目
如果风险评估后包装材料不等同,则需要根据包装与器械产品的接触性质,选择适当的测试来证明材料的安全性。例如:如果产品和包装材料之间无直接或间接接触,则只需要进行材料鉴定(红外鉴别等)和简单的化学测试(提取溶液的不挥发残渣、紫外吸收等)即可;如果产品和包装材料之间只是固体形式的直接接触,则除了以上测试项目外,还需要对包材的粒子和细胞毒性等项目进行考察;如果器械和包装材料有半固体、液体或其组合形式的直接接触,这种接触方式风险很高,则另外需要对包材进行化学表征分析中的可浸提物与可沥滤物(E&L)的研究和评估。由于科学完整的E&L研究,只能代替和豁免涉及到全身性反应的生物测试部分,例如急性全身性毒性、亚急性全身性毒性、亚慢性全身性毒性、慢性全身性毒性、致癌性、基因毒性、生殖发育毒性等,所以细胞毒性、皮肤刺激、致敏以及血液相容性、植入实验中对组织的局部影响部分,则可能需要额外的测试来支持包装材料的监管应用。
3.4化学成分的毒理评估
科学合理的E&L研究,一般都会识别、鉴定和量化出一些可浸提物(潜在的可沥滤物)或者可沥滤物,这些物质是否超出人体可接受限度(TI),需要有经验的毒理专家进行毒理评估。结合各种毒理数据库和个人的经验,毒理专家会计算这些物质的毒性,并评估其安全性。
3.5生物相容性的总结
根据以上收集的包材有关的物理/化学/毒理等信息,结合生物风险评估结果以及化学表征分析或/和生物相容性测试,再结合毒理评估结果(可能适用),就可以形成一份完整的关于包装材料的生物相容性风险评估报告。
04化学表征分析
4.1化学表征分析与生物相容性评价的关系
化学表征分析是生物风险评估和生物相容性评价的一部分。当包材有关的物理/化学/毒理等信息收集不全时,需要根据生物风险评估结果,决定是否需要做生物相容性测试(包括化学试验和生物试验)。风险评估的核心是需要了解和阐明产生毒性的物质信息和定量结果,而不是动物实验的定性结果,所以化学表征分析优先于生物试验。
4.2化学表征分析的内容
化学表征分析内容广泛,包含各种物理和化学测试类型。物理分析项目包括:傅里叶变换红外光谱(FTIR)鉴别、扫描电子显微镜(SEM)进行的材料表面形态分析等;化学分析包含非特异成分分析,例如提取溶液的不挥发残渣、紫外吸收、总有机碳含量等,以及特异性成分分析,例如可浸提物与可沥滤物(E&L)的研究。建议读者参考有关标准和指南,以确定是否需要进行测试来解决这些评估,以及哪些评估适用于给定的包装应用。
4.3可浸提物与可沥滤物(E&L)研究
可浸提物与可沥滤物(E&L)研究是化学表征分析中的一个重要内容。对于高风险的医疗器械包装,如果使用了全新的材料、生产过程中使用了新的化学物质(加工助剂)或常规的生物相容性研究中发现了预期外的现象和反应,亦或含有已知毒性的物质,但是通过传统的生物相容性实验不能阐明和降低毒性风险时,E&L研究就成了必要的一个环节。
包装材料的E&L研究,可以参考医疗器械有关的标准和指南进行,例如ISO 10993-18:2020[6]、医疗器械已知可沥滤物测定方法验证及确认注册技术审查指导原则[9]、医疗器械未知可沥滤物评价方法建立及表征技术审查指导原则(征求意见稿)[10]等。E&L研究的方案设计及操作过程必须科学完整合理,否则得到的研究结果并不能反映材料的真实情况,从而影响生物相容性的准确评估。
需要说明的是,单纯的化学表征分析一般不足以证明材料的等同性和生物相容性,需要结合毒理学资料、材料的物理学特征、后续处理方式、器械的临床用途、包材和器械的接触形式以及合适的生物试验等进行综合评估。
05总结
医疗器械包装,尤其是对高风险医疗器械的包装进行生物相容性的评估,是很多法规和标准的要求,需要引起行业的重视。本文希望通过包装的生物相容性评价和生物相容性试验的选择,为医疗器械的生物安全提供保障,同时也为高端医疗器械的研发和上市加快进程。
参考文献
[1] 国家药品监督管理局. 《医疗器械注册管理办法》.
[2] ISO 11607-1:2019 Packaging for terminally sterilized medical devices — Part 1: Requirements for materials, sterile barrier systems and packaging systems. 2019
[3] ASTM F2475-20. Standard Guide for Biocompatibility Evaluation of Medical Device Packaging Materials.2020
[4] ISO 10993-1:2018. Biological evaluation of medical devices — Part 1: Evaluation and testing within a risk management process.2018
[5] FDA Center for Devices and Radiological Health: 2020 Biocompatibility Guidance: Use of International Standard ISO 10993-1, "Biological evaluation of medical devices – Part 1: Evaluation and testing within a risk management process" .2020
[6] ISO/TS 21726:2019, Biological evaluation of medical devices — Application of the threshold of toxicological concern (TTC) for assessing biocompatibility of medical device constituents.2019
[7] ISO 10993-18:2020. Biological evaluation of medical devices — Part 18: Chemical characterization of medical device materials within a risk management process.2020
[8] ISO 10993-17:2002. Biological evaluation of medical devices — Part 17: Establishment Of Allowable Limits For Leachable Substances.2002
[9] 国家药品监督管理局.医疗器械已知可沥滤物测定方法验证及确认注册技术审查指导原则.2019
[10] 国家药品监督管理局.医疗器械未知可沥滤物评价方法建立及表征技术审查指导原则(征求意见稿).2020

来源:SGS生命科学服务


