您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-09-17 11:46
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
欧康维视眼科新药获批Ⅲ期临床。欧康维视9%地塞米松植入剂OT-502(Dexycu)获国家药监局临床试验默示许可,即将开展用于白内障术后炎症治疗的Ⅲ期临床。Dexycu是EyePoint公司开发的一款新型、可生物降解的单次注射的缓释抗炎药物,已在美国获批上市,用于眼科术后炎症适应症。值得一提的是,此前OT-502作为临床急需药物已获得在海南博鳌乐城超院试点销售资格;CDE还批准它在博鳌乐城开展真实世界研究。
国内药讯
1.泽布替尼新适应症获FDA加速批准。百济神州BTK抑制剂百悦泽(泽布替尼)获FDA加速批准,用于治疗接受过至少一次抗CD20治疗的复发或难治性(R/R)边缘区淋巴瘤(MZL)成年患者。在一项关键性Ⅱ期临床MAGNOLIA中,经CT评估的ORR为56%(95% CI: 43, 68),经PET-CT评估的ORR为67%(95% CI: 54, 78);中位随访为8.3个月时,中位DoR尚未达到。此前,FDA已批准泽布替尼用于治疗套细胞淋巴瘤经治患者,和华氏巨球蛋白血症患者。
2.广州麓鹏BCL-2抑制剂上I期临床。广州麓鹏制药新一代BCL-2抑制剂LP-118的I期临床(CTR20211648)完成首例患者给药。该项研究由广东省人民医院吴一龙教授担任主要研究者,旨在评估LP-118用于治疗晚期恶性肿瘤的安全性和初步疗效、探索最大耐受剂量(MTD)和剂量限制性毒性(DLTs),人体药代动力学(PK)特征以及确定后期临床研究推荐剂量。
3.CD20xCD3双抗获批临床。诺诚健华和康诺亚联合宣布,双方合资公司天诺健成研发的CD20xCD3双抗CM355已获国家药监局临床试验默示许可,即将开展用于CD20+B细胞血液瘤的临床试验。CM355特异性结合CD20阳性靶细胞和CD3阳性T细胞,将免疫T细胞招募至靶细胞周围,激活T细胞,诱导T细胞介导的肿瘤细胞杀伤(TDCC)作用杀伤靶细胞。CM355抗体已在临床前研究中显示出良好的抗肿瘤效果。
4.深圳埃格林抗新冠药物在印度获批临床。深圳埃格林医药糖皮质激素受体调节剂EG-009A获印度监管部门批准,即将在印度开展Ⅱ期临床,评估EG-009A用于德尔塔变种病毒所致中重度新冠肺炎患者的治疗效果。在临床前药理学实验中,EG-009A已显示出对于新冠病毒所致细胞因子风暴的清晰疗效。FDA此前已批准在美国开展EG-009A治疗中重度新冠肺炎的Ⅱ期临床。
5.赛生药业引进新型小分子偶联药物。赛生药业与Tarveda Therapeutics就Tarveda拟用于实体瘤的新型小分子偶联药物(PI3K抑制剂和HSP90)达成合作与许可协议,赛生药业将获得这款临床前期候选品种在大中华区(包括中国大陆、香港、澳门及台湾地区)开发、生产和商业化权益。根据协议,Tarveda公司将获得一笔首付款,股权投资,里程碑后期付款以及合作产品的销售分成。
国际药讯
1.武田EGFR-TKI品种获FDA加速批准。FDA加速批准武田(Takeda)EGFR-TKI靶向药物Exkivity(mobocertinib)上市,用于治疗EGFR外显子20插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)经治患者。这也是FDA批准的首款用于这类NSCLC患者的口服疗法。在一项Ⅰ/Ⅱ期临床中,mobocertinib达到28%的确认客观缓解率,中位缓解持续时间为17.5个月,中位总生存期为24个月,中位无进展生存期为7.3个月。在中国,mobocertinib已被CDE纳入突破性治疗品种。
2.Opdivo治疗头颈癌获英国批准上市。百时美施贵宝肿瘤免疫疗法Opdivo(nivolumab)获英国国家卫生与临床优化研究所(NICE)批准,纳入英国国家医疗服务体系(NHS),用于治疗转移性和复发性头颈癌患者。在一项关键Ⅲ期CHECKMATE-141研究中,与研究者选定的方案相比,Opdivo显著延长了总生存期(中位OS:7.5个月vs5.1个月,p=0.0101),将死亡风险降低30%。
3.“渐冻症”新药AMX0035在美报NDA。FDA受理Amylyx公司复方制剂AMX0035(苯丁酸钠/牛磺酸二醇)的新药申请(NDA),用于治疗肌萎缩侧索硬化症(ALS,渐冻症)。在一项CENTAUR试验中,AMX0035与安慰剂相比延长了患者中位总生存期(25个月vs18.5个月),将患者死亡风险降低44%(HR,0.56;95% CI,0.34-0.92;P=0.023)。该公司预计今年年底前向欧洲药品管理局(EMA)提交AMX0035的营销授权申请(MAA)。
4.基因编辑治疗HIV获批Ⅰ期临床。Excision BioTherapeutics公司拟用于功能性治愈慢性1型人类免疫缺陷病毒(HIV-1)感染的CRISPR基因编辑疗法EBT-101获FDA临床许可,即将开展Ⅰ/Ⅱ期临床,评估用于治疗HIV-1感染者的安全性和有效性。在临床前研究中,EBT-101已在多种细胞系中显示出切除HIV前病毒DNA的能力,包括人类原代细胞,以及非人灵长类在内的多种动物模型。
5.关节炎创新疗法Ⅲ期临床积极。Ampio公司NF-κB激活抑制剂Ampion(门冬氨酰-丙氨酰二酮哌嗪,DA-DKP)治疗严重骨关节炎(OAK)的Ⅲ期临床AP-013获积极结果。与生理盐水对照组相比, Ampion治疗组12周时患者疼痛在统计学上显著减轻(p=0.0260),功能显著改善(p=0.0073);试验中未观察到治疗相关的严重不良事件。Ampio计划向FDA提交其生物制品许可申请(BLA)。
6.Moderna拟开发mRNA编码抗体疗法。AbCellera公司与Moderna公司将利用AbCellera专有的AI抗体发现技术平台,联合开发mRNA编码抗体疗法。根据协议,AbCellera将获得研究资金,开发和商业里程碑后期付款、以及产品净销售额的特许权使用费。AbCellera将利用其抗体发现技术平台为Moderna开发可多达6个靶点的候选治疗性抗体。Moderna将有权开发和商业化合作产生的mRNA编码抗体疗法。
7.赛诺菲BTK抑制剂Ⅲ期临床失败。赛诺菲旗下Principia公司BTK抑制剂rilzabrutinib在治疗罕见自身免疫性皮肤病天疱疮的首个关键Ⅲ期临床中没有达到主要终点和关键次要终点。受此影响,赛诺菲计划关闭Principia公司旧金山的实验室并裁员38人。去年11月,FDA已授予Rilzabrutinib治疗免疫性血小板减少症(ITP)的快速通道资格。该公司未来将在ITP和自身免疫性IgG4相关疾病中继续评估rilzabrutinib的治疗潜力。
医药热点
1.卫生领域300亿元中央投资下达。国家发改委近日分步有序下达2021年度卫生健康领域中央预算内投资300亿元。2021年,对照疾控机构建设标准,安排中央投资84.44亿元,支持省、市、县三级疾控中心建设。针对肿瘤、心脑血管等领域重点病种,安排中央投资40.15亿元,支持54个省部级医院提升省域内相关专科综合诊治能力。安排中央投资27.71亿元,支持省级妇科、儿科项目以及人口大市妇幼保健机构项目建设。
2.美国政府再次购买新冠鸡尾酒。美国卫生与公共服务部(HHS)和国防部(DOD)将额外购买再生元140万剂新冠抗体鸡尾酒疗法REGEN-COV(casirivimab和imdevimab),用于治疗和预防新冠肺炎,采购总价高达29.4亿美元,交货截止日期为明年1月底。加上此前再生元与美国政府达成的160万剂REGEN-COV的购买协议,美国政府向该公司新冠肺炎抗体疗法的总采购量已达到了300万剂。
3.欧洲ESMO年会正式开幕。2021年欧洲肿瘤内科学会(ESMO)年会将于9月16日至21日举行。康方生物、康宁杰瑞、科济药业、和铂医药、来凯医药、基石药业、信达生物、恒瑞医药、诺诚健华、乐普生物、友芝友生物、君实生物等许多中国公司的抗癌创新药研究成果将于会议期间与同行分享,其中包括抗体偶联药物(ADC)、双特异性抗体、单抗、CAR-T产品、小分子抑制剂等许多创新疗法。
评审动态
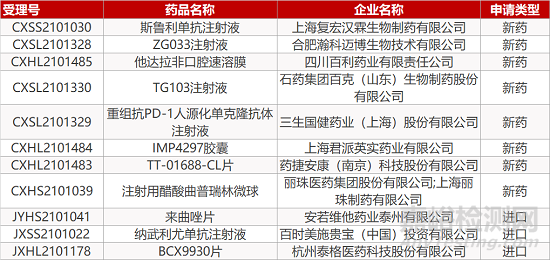
申请临床:
合肥瀚科迈博生物的ZG033注射液、四川百利药业的他达拉非口腔速溶膜、石药集团百克(山东)生物的TG103注射液、三生国健药业的重组抗PD-1人源化单克隆抗体注射液、上海君派英实药业的IMP4297胶囊、药捷安康的TT-01688-CL片、杭州泰格医药的BCX9930片。
申请生产:
上海复宏汉霖的斯鲁利单抗注射液、丽珠医药集团的注射用醋酸曲普瑞林微球、安若维他药业的来曲唑片、百时美施贵宝的纳武利尤单抗注射液。

来源:药研发


