您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-08-22 21:40
8月对于Hancock Jaffe Laboratories 来说可谓好事连连,月初其产品VenoValve获得FDA授予“突破性设备”称号。最近有公布VenoValve两年静脉瓣膜临床数据,临床数据有力支持VenoValve安全性和有效性。
两年的VenoValve临床数据显示:反流、疾病表现和疼痛的平均改善率分别为63%、60%和93%。
VenoValve优异临床效果,为全球的下肢慢性静脉功能不全(CVI)患者带来了新希望。
下肢慢性静脉功能不全(CVI)拥有广大患者群体,仅在美国就有240万患者,全世界每年新增患者高达200多万。但是下肢慢性静脉功能不全(CVI)却缺乏有效治疗手段,因此患者不得不承受疾病带来痛苦,下肢慢性静脉功能不全(CVI)产生的“逆流”或反流会引起疼痛、瘙痒、严重和不可控制的肿胀,从而导致活动能力降低和严重的长期皮肤溃疡。
下肢慢性静脉功能不全(CVI)拥有广阔市场,一旦治疗技术得到突破,必将成为下一个大蓝海,如同神经介入、结构性心脏病一样引爆市场。
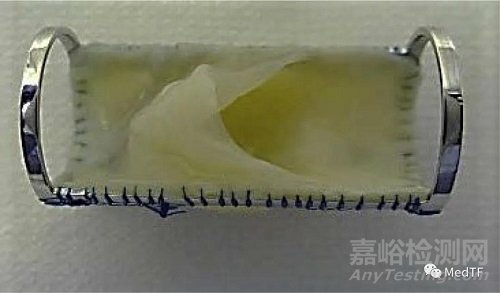
VenoValve
VenoValve是一种生物静脉瓣,用于纠正或减少深静脉系统内的静脉回流。VenoValve包括由金属支架和生物瓣膜组成,金属支架将允许将生物假体直接通过外科手术插入股深静脉。
外血流动力研究

动物研究

向上的静脉造影图,显示VenoValve的通畅性,允许正常定向的血流返回心脏

下行静脉造影图,显示VenoValve关闭,防止静脉血液反流
VenoValve优势
为下肢慢性深静脉功能不全患者的治疗提供标准治疗,改善静脉回流;
为10-35%的成人下肢深静脉功能障碍患者提供持久的解决方案,减少每年因下肢慢性深静脉功能不全而损失的数十亿美元;
VenoValve的植入可通过超声检查确定,植入后也可以通过超声确认瓣膜功能;
手术可在局部麻醉下进行,无需全麻。
VenoValve临床研究
Hancock Jaffe Laboratories 完成了VenoValve首次人体临床试验,本次试验是在哥伦比亚波哥大进行,一共有11名患者参与。
VenoValve术后一年,研究结果显示11名患者的静脉反流平均改善了54%,通过静脉临床严重程度评分( VCSS)显示改善了56%,视觉模拟评分法(“VAS”)评估显示疼痛改善了76%。
VenoValve术后两年,研究结果显示8名患者的静脉反流平均改善了63%,通过静脉临床严重程度评分( VCSS)显示改善了60%,视觉模拟评分法(“VAS”)评估显示疼痛改善了93%。(其中另外三名患者选择不参随访,但在他们在一年随访期间未报告任何与静脉瓣膜相关的不良事件。)
排除三名患者后,VenoValve术后两年临床效果比术后一年大幅提高。但由于参与患者太少,需要更大规模临床数据进一步证明VenoValve安全性和有效性。
为此Hancock Jaffe Laboratories 将结合四月份批准IDE研究,将在美国开展静脉瓣膜关键研究,本研究将包括多达20个中心的75名患者。本研究的主要终点与首次人体试验相同:主要安全终点是在静脉瓣膜植入术后30天,少于10%的患者发生MAE,主要疗效终点是静脉瓣膜手术后6个月内反流改善程度等于或大于30%。VCSS和VAS评分的改善也作为次要终点纳入研究。
MAE 被定义为全因死亡率、深部伤口感染、大出血、同侧深静脉血栓形成 (DVT) 或肺栓塞的复合。

来源:MedTF


