您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-27 18:42
确保生物治疗产品的稳定性对其安全性和有效性有关键影响,这仍然是生物制药行业面临的主要挑战。单克隆抗体(mAb)尤其如此,它是当今大多数商业化生物药物的来源。聚集和化学修饰(例如片段化)等物理效应是mAb降解的两条主要途径。动力学建模可以成为建立产品稳定性的有效工具,提供对这些过程的更深入了解,并允许开发人员在过程和产品开发的早期阶段降低产品降解的风险。
蛋白质稳定性风险
单克隆抗体是目前领先的一类蛋白质治疗分子,因为它们能够治疗多种致命和危及生命的疾病,包括癌症、埃博拉、多发性硬化症、类风湿性关节炎、银屑病和哮喘。FDA已经批准了许多抗体药物分子,它们处于临床和临床前开发的各个阶段。但由于最终药物产品的主要成分是蛋白质,因此这些药物分子的稳定性存在重大风险。
与各种关键质量属性(例如,聚集、断裂、电荷变异和糖基化)相关的不稳定性仍然是生物制药行业的主要问题。它可以直接或间接地影响mAb的生物学活性和药效。
与mAb相关的不稳定性可以大致分为物理或化学两个方面。聚集是主要的物理不稳定性之一,被认为会影响治疗制剂的免疫原性。
不同类型的化学不稳定性包括脱酰胺、氧化、断裂和水解。尽管这些不稳定性(物理和化学)的影响可能因不同类别的mAb分子而不同,但生物制药制造企业希望将它们降至最低。聚集和断裂是mAb的两个最重要的降解途径。它们会在产品开发的各个阶段出现不稳定,包括上游加工(细胞培养中的蛋白质表达期间)、下游加工(纯化)、产品配方开发、储存和运输。
影响mAb稳定性的因素
影响mAb治疗制剂稳定性的因素可能与其结构(一级、二级或三级)或环境有关。在一级结构中,如果蛋白质的表面电荷分布或疏水性发生变化,则会变得不稳定。二级结构的改变,尤其是蛋白质分子β含量的增加,会使其更容易聚集。可能对蛋白质产生影响的环境因素包括pH值、温度、盐浓度、缓冲液类型、蛋白质浓度、离子强度、混合、剪切力、金属离子、压力、冻融、冷冻干燥和重构。
蛋白质可能会因为这些因素而发生变化,通过物理结合(聚集)或化学降解(碎片)来改变其物理结构。这篇文章讨论了这些降解途径的动力学以及揭示可帮助开发人员确保生物制剂产品稳定性的见解。
研究案例1:mAb产品的聚合
模拟蛋白质聚集的动力学和热力学对于理解其机制很有价值。与动力学数据相关的蛋白质聚集的数学建模可以帮助开发人员获得对聚集背后机制的定性和定量见解。有了这些知识,开发人员可以通过优化时间框架和环境条件来更好地预测和控制抗体聚合。
许多蛋白质聚集模型已经存在,包括Lumry-Eyring模型,它是预测聚集动力学最常用的模型之一。根据该模型,聚集发生在两个步骤中:蛋白质分子的构象可逆展开,然后不可逆地组装成聚体,它们彼此使用物理或化学连接。
许多研究人员修改了Lumry-Eyring模型以解释成核和更高级聚集的产生。例如扩展的Lumry-Eyring(ELE)模型和Lumry-Eyring成核聚集(LENP)模型。此外,替代模型已经提出了诸如朊病毒、淀粉样蛋白β和胰岛素等蛋白质的替代聚集模型。
Lumry-Eyring成核聚集(LENP)模型
Lumry-Eyring模型将成核的概念引入到聚集中。该模型中呈现的动力学反应方案取决于:反应顺序、起始蛋白质浓度和不同蛋白种类之间的粒度分布。
该模型中考虑的参数是核化学计量(x)、在每个生长步骤中添加的单体(δ)以及成核和生长的逆速率系数。这些速率系数表示相应的时间尺度(τn和τg)。
Lumry-Eyring模型(ELE)
另一个用于聚集动力学分析的模型是扩展的Lumry-Eyring(ELE)模型。通过这种方法,展开被认为是一种单一的可逆限速反应,折叠的天然和反应性未折叠单体物质彼此处于热力学平衡状态。该模型考虑了聚集过程中发生的可逆和不可逆构象变化。它还考虑了溶液的构象和动力学胶体稳定性。将基于浓度的实验数据拟合到模型方程中以计算表观速率常数并预测单体降解速率。
聚合样品制备和表征
为了监测和了解蛋白质中的聚集机制及其行为,选择了等电点(pI)为8.5的模型蛋白质(mAb)。在下游纯化期间生物制药行业普遍存在的条件下,使用缓冲液交换来监测该mAb的聚集动力学。
详细的实验程序和条件详见参考文献1。简而言之,所检查的缓冲液包括那些常用于蛋白A层析、阳离子交换层析和阴离子交换层析的缓冲液。
将样品以10mg/mL的浓度保存在三种不同的温度(4℃、15℃和30℃)下。在间歇时间点进行了超过120小时的采样。使用分子排阻高效液相色谱(SE-HPLC)分析样品的聚体含量,并使用动态光散射(DLS)(如下图1A)分析低聚物类型。
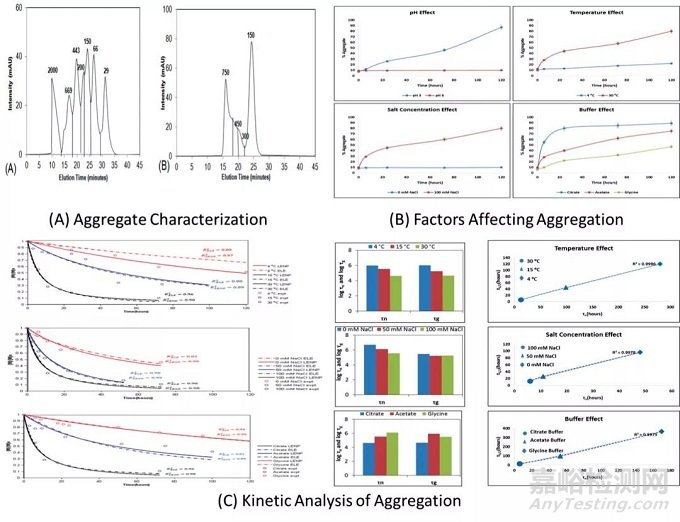
图1:聚合表征、分析和建模数据。
所有实验样品一式三份以确保重现性。使用MATLABR2011a分析SE-HPLC获得的聚集数据并拟合到ELE和LENP模型中。然后使用高斯-牛顿算法求解常微分方程组(ODE)以估计模型参数。
影响mAb聚集的因素
发现聚集在低pH值下达到最大值,并随着温度和盐浓度的增加而加速。低pH值下的聚集主要与抗体的可结晶片段(Fc)结构域的变化有关。这些变化包括mAb Fc结构域的部分解折叠,这导致疏水残基暴露。这些之前埋在分子内部的疏水残基相互吸引。这导致在低pH值下聚集增强。上图1B说明与蛋白A纯化条件(低pH)相比,在阳离子和阴离子交换(CEX和AEX)缓冲条件(高pH)下聚集较少。此外,较高的温度导致mAb结构部分或完全展开,并由于蛋白质分子在较高温度下的不稳定性而导致聚集(如上图1B)。
盐的存在也会影响蛋白质的稳定性,其程度取决于盐的类型、浓度、蛋白质电荷以及蛋白质和盐的相互作用(如上图1B)。随着盐浓度的增加,可以看到聚集速率的增加。除了这些因素之外,缓冲液种类的类型似乎对蛋白质产品的稳定性也有深远的影响。
与柠檬酸盐和醋酸盐缓冲液相比,甘氨酸缓冲液具有更高的稳定性(如上图1B),这取决于mAb分子的Fc结构域与不同缓冲液种类的相互作用。从圆二色性(CD)光谱和DLS测量获得的结果也支持这些观察结果。总结后发现,可以说pH是蛋白质聚集的最重要因素,其次是温度、盐浓度和缓冲液种类。
mAb聚集动力学建模
使用ELE和LENP模型拟合从SE-HPLC分析获得的数据,并通过将实验值与模型预测值进行比较评估来判断模型的准确性。使用两种模型进行曲线拟合以计算回归系数(R2值)。模型比较发现LENP模型在预测聚集动力学方面比ELE更好。
然后使用结果来计算成核(τn)和生长(τg)的时间,以预测聚集动力学(如上图1C)。在不同的孵育条件下比较了成核和生长时间的建模参数。注意到,随着温度从4℃增加到30℃(对于pH3.0的柠檬酸盐缓冲液和100mM NaCl),成核和生长时间减少,意味着更快的聚集(如上图1C)。
随着温度从4℃增加到30℃,成核时间和单体半衰期之间也存在线性关系。高温下更快的单体损失归因于蛋白质扩散增加导致碰撞频率增加。
在将盐浓度从0mM NaCl增加到100mM NaCl时观察到类似的效果(如上图1C)。这可能是由于盐离子化造成的,这会削弱蛋白质结构并降低稳定性,因为随着盐浓度的增加,疏水相互作用和静电排斥力减弱。
总体而言,对于所考虑的系统,pH3.0的柠檬酸盐缓冲液与乙酸盐和甘氨酸缓冲液相比显示出最快的单体损失(如上图1C)。在不同条件下,成核时间和单体半衰期之间存在线性相关性,斜率在0.4-0.5之间,表明成核在mAb中占主导地位,因此LENP模型提供比ELE模型有更好的拟合(如上图1C)。
研究案例2:mAb片段化
片段化包括将mAb分解成更小的单元,使用热能或化学能进行。断裂会导致氨基酸之间的键断裂,从而改变分子的一级结构,并最终改变其他更高级的改变。mAb铰链区肽键的裂解(水解)导致Fc-Fab和Fab的形成。
不同类别的mAb分子的响应在碎片现象方面有所不同,具体取决于每个分子的遗传一级结构。制剂缓冲系统中的各种污染物(例如,金属离子和蛋白酶)会显着影响碎片化程度,并且降解可能发生在mAb生产和加工的各个阶段。基于分子大小的监测工具,例如SEC、DLS、质谱(MS)和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),通常用于检测碎片并识别形成的各种物质。
碎片样品制备和表征
mAb样品在配制缓冲液(15mM磷酸盐,pH6.5,含150mM NaCl和0.02%聚山梨酯80)中超滤,最终浓度为5mg/mL。然后将该样品在50℃下孵育,并通过SEC-HPLC定期监测碎裂程度(如下图2A和2B)。
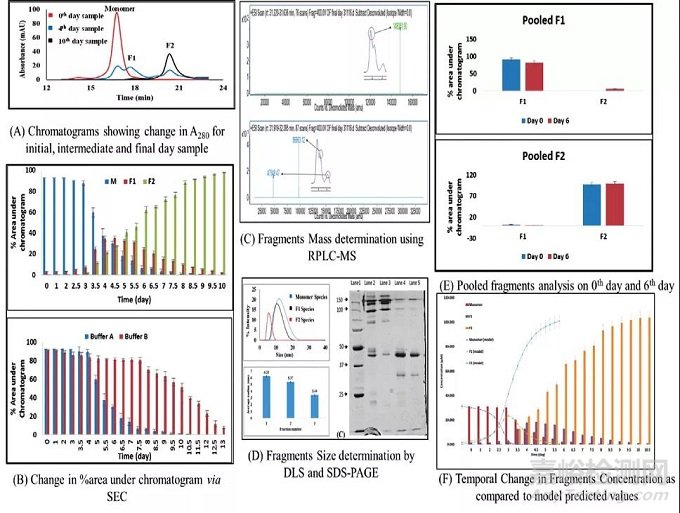
图2:碎片化表征、分析和建模数据。
各种其他分析技术(例如,DLS和SDS-PAGE)用于确认形成的片段的大小(如上图2D)。使用带质谱的反相高效液相色谱(RPHPLC-MS)分析完整mAb样品以及碎片化mAb样品和纯化和富集的片段种类,以定位mAb分子中的碎片化位点(如上图2C)。
SEC、DLS、SDS-PAGE和MS分析的结果发现,在完整单体(148KDa)mAb分子片段1(96.9KDa)和片段2(47.3KDa)裂解后形成了两种不同的片段种类(如上图2C)和二维结构。这表明断裂发生在mAb的铰链区,导致Fc-Fab和Fab片段的形成,与已发表的结果(参考文献2)相对应。
mAb碎片动力学建模
通过SEC观察碎片趋势,可以推断单体mAb分子(M)随着时间的推移分解为两种物质(F1和F2)。分析这三个物质(M、F1和F2)浓度变化的时间趋势,注意到,最初,在72小时内,M的浓度缓慢下降,然后突然上升。F1和F2片段也以增量方式遵循这一趋势(如上图2A)。这种基于时间的分析是在不同温度下进行的,以证实我们的假设,碎片模型基于该假设。我们认为碎片现象本质上是自催化的,这是基于这样一种假设,即需要一定浓度的碎片与完整的单体分子反应以进一步加速其降解。为了确认所提出的模型在本质上是通用的,它在另一个缓冲系统上进行了测试,温度为50℃(15mM磷酸盐,离子强度-29mM,pH6.8和0.015%PS80)(如上图2B)。
对两个数据集的实验结果进行分析后发现,虽然两种缓冲液系统的碎片趋势相同,但由于两种缓冲液的离子强度不同,碎裂速度略有不同。大约57%的单体mAb在四天内转化为片段。碎裂的动力学模型是基于从SEC获得的结果。SEC分析表明,在整个研究过程中,聚体的百分比是恒定的,证明它们对破碎过程的影响较小。
碎片率的突然增加
此外,碎裂率最初是渐进的,但在第四天突然增加,直到样品完全降解。此外,观察到单体峰旁边的峰是第一种片段种类(F1或Fc-Fab),第二个峰是第二种片段种类(F2或Fab)。
F1的浓度在开始时增加然后减少。F2的浓度在整个研究过程中不断增加。在检查这些观察结果时,提出了以下机制:
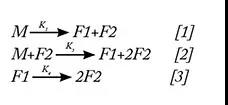
此外,该模型在三种不同的温度(40℃、45℃和50℃)下进行了实验验证。动力学分析结果表明反应[1]为负活化能的非阿伦尼乌斯反应(化学反应速率常数随温度变化关系的经验公式)。这也在另外两个温度(30℃、35℃)下进行了检查。在所有五个温度下,趋势都是非阿伦尼乌斯,具有负活化能(如下表1)。
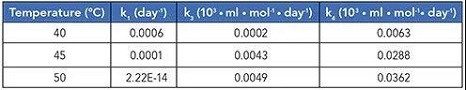
表1:对于在三个不同温度下的相同样品,获得的动力学速率常数。
通过对F1和F2进行纯化和收集,并将它们分别在50℃下孵育,证实了反应[3]。F1(Fc-Fab)解离为Fc和Fab片段,发现F2片段是最终产物,之后样品完全降解(如上图2E)。
在所有速率常数中,虽然k1不遵循阿伦尼乌斯动力学,但k3和k4遵循大于0.75的R2方程。此外,k3和k4表现出与对应于增加的碎裂的温度的线性关系(如下表2)。
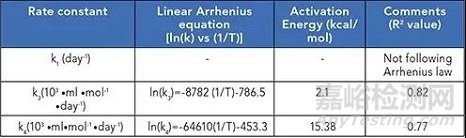
表2:ln(k)与(1/T)的线性阿伦尼乌斯图拟合的R2值。该表包括活化能值以及拟合方程。
MATLAB R2015b用于分析SEC-HPLC获得的碎片数据,然后将其拟合到建议的模型方程中以获得速率常数(如上图2F)。对于所有片段种类,发现当R2值大于0.9,证明该模型具有统计学意义。
总结
因为mAb是蛋白质,所以mAb是高度敏感的不稳定分子,很容易通过聚集和断裂降解。本文讨论了动力学建模,并展示了如何将其用作早期评估蛋白质稳定性的工具。

来源:药时空


