您当前的位置:检测资讯 > 实验管理
嘉峪检测网 2021-07-13 20:13
紫外-可见(UV-Vis)光谱是一种广泛应用于许多科学领域的技术,从细菌培养、药物鉴定和核酸纯度检查和定量,到饮料行业的质量控制和化学研究。本文将介绍UV-Vis光谱的工作原理、如何分析输出数据、该技术的优势和局限性以及它的一些应用。
什么是紫外可见分光光度计?
UV-Vis光谱是一种分析技术,它测量与参考或空白样品相比样品吸收或透射过的UV或可见光的离散波长的数量。此属性受样品成分的影响,分析结果可能会提供有关样品中成分和浓度的信息。由于这种光谱技术依赖于光的使用,所以让我们首先谈一谈光的特性。
光具有与其波长成反比的一定量的能量。因此,较短波长的光携带更多的能量,而较长波长的光携带较少的能量。需要特定量的能量来将物质中的电子提升到更高的能量状态,我们可以将其检测为吸收。物质中不同键合环境中的电子需要不同的特定能量来将电子提升到更高的能量状态。这就是为什么在不同物质中对不同波长会发生光吸收的原因。人类能够看到一系列可见光,从大约380nm(我们看到的紫色)到780nm(我们看到的红色)。紫外光的波长比可见光短,约为100nm。因此,光可以通过其波长来描述,这在UV-Vis光谱中可用于通过定位与最大吸光度相对应的特定波长来分析或识别不同的物质(参见下文中UV-Vis光谱的应用部分)。
紫外可见分光光度计如何工作?
虽然UV-Vis分光光度计有许多类型,但为了更好地了解UV-Vis分光光度计的工作原理,我们主要考虑分光光度计的主要组件,如下图1所示。
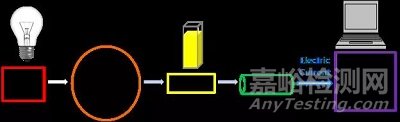
图1:紫外可见分光光度计主要组件的示意图。
1、光源
作为一种基于光的技术,一个能够在很宽的波长范围内发射光的稳定光源是必不可少的。单个氙气灯通常用作紫外线和可见光范围的高强度光源。然而,与钨灯和卤素灯相比,氙气灯的成本更高且稳定性较差。
对于使用两个灯的仪器,钨灯或卤素灯通常用于可见光,而氘灯是紫外光的常见光源。由于需要两种不同的光源来扫描紫外和可见波长,因此在测量过程中必须切换仪器中的光源。在实践中,这种切换通常发生在300和350nm之间的扫描范围,其中来自两个光源的光发射相似,并且可以更平滑地进行转换。
2、波长选择
在下一步中,必须从光源发出的宽波长中选择适合用于检测的样品类型和分析物的特定波长的光进行样品检查。常用的方法包括:
单色器
单色器将光分成窄的波长带。它通常基于可以旋转的衍射光栅来选择入射角和反射角,从而选择所需的光波长。衍射光栅的凹槽频率通常以每毫米的凹槽数来衡量。更高的凹槽频率提供更好的光学分辨率,但可用波长范围更窄。较低的凹槽频率提供较大的可用波长范围,但光学分辨率较差。每毫米300到2000个凹槽可用于紫外可见光谱目的,但通常每毫米至少有1200个凹槽。光谱测量的质量对衍射光栅和光学装置中的物理缺陷很敏感。因此,刻划衍射光栅往往比闪耀全息衍射光栅具有更多的缺陷。闪耀全息衍射光栅往往能提供明显更好的测量质量。
吸收滤光片
吸收滤光片通常由有色玻璃或塑料制成,旨在吸收特定波长的光。
干涉滤光片
也称为二向色滤光片,这些常用的滤光片由多层介电材料制成,其中在薄层材料之间发生干涉。这些滤光片可用于通过相消干涉消除不需要的波长,从而充当波长选择器。
截止滤光片
截止滤光片允许低于(短波)或高于(长波)特定波长的光通过。这些通常使用干涉滤波器来实现。
带通滤波器
带通滤波器允许一系列波长通过,这可以通过将短波和长波滤波器组合在一起来实现。
由于其多功能性,单色仪最常用于该过程。然而,滤光片通常与单色器一起使用,以缩小选择的光波长以进行更精确的测量并提高信噪比。
3、样品分析
无论在分光光度计中使用哪种波长选择器,光都会穿过样品。对于所有分析,测量参考样品(通常称为“空白样品”)(例如装有用于制备样品的类似溶剂的比色皿)是必不可少的。如果使用含有样品的缓冲溶液进行测量,则使用不含目标物质的缓冲溶液作为参考。检查细菌培养物时,将使用无菌培养基作为参考。参考样品信号随后由仪器自动使用,以帮助获得分析物的真实吸光度值。
了解UV-Vis光谱实验中使用的材料和条件非常重要。例如,大多数塑料比色皿不适用于紫外线吸收研究,因为塑料通常会吸收紫外线。玻璃可以充当过滤器,通常会吸收大部分UVC(100-280nm)和UVB(280-315nm)但允许一些UVA(315-400nm)通过。因此,紫外检测需要石英样品架,因为石英对大部分紫外光是透明的。空气也可以被认为是一种过滤器,因为波长短于约200nm的光被空气中的分子氧吸收。波长小于200nm的测量需要特殊且更昂贵的设置,通常涉及充满纯氩气的光学系统。无比色皿系统也可用于分析非常小的样品体积,例如在DNA或RNA分析中。
4、检测
光线穿过样品后,检测器用于将光线转换为可读的电子信号。通常,探测器基于光电涂层或半导体。
光电涂层在暴露于光喷出带负电荷的电子。当电子被射出时,会产生与光强成正比的电流。光电倍增管(PMT)是紫外-可见光谱中较常用的检测器之一。参考下图2,PMT基于光电效应,在曝光时首先发射电子,随后发射的电子依次倍增以产生更大的电流。PMT检测器对于检测非常低的光强度特别有用。
当半导体暴露在光下时,可以通过与光强成正比的电流。更具体地说,光电二极管和电荷耦合器件(CCD)是两种最常见的基于半导体技术的检测器。
使用任何探测器产生电流后,信号就会被识别并输出到计算机或屏幕上。如上图2和下图3显示了紫外-可见分光光度计布置的一些简化示意图。
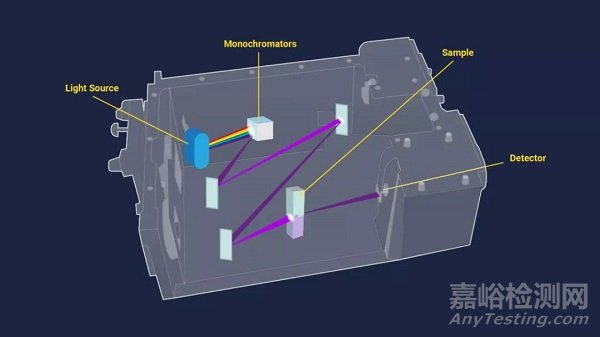
图2:基于比色皿的紫外-可见光谱系统示意图。
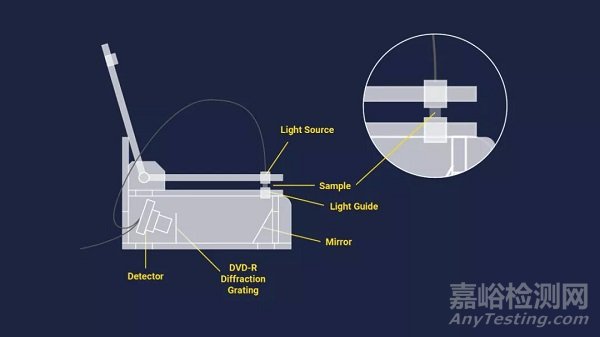
图3:无比色皿UV-Vis光谱系统示意图。
紫外-可见光谱分析、吸收光谱和吸光度单位
UV-Vis光谱信息可以表示为吸光度、光密度或透射率与波长的函数关系图。但是,该信息通常以y轴(纵轴)上的吸光度和x轴(横轴)上的波长的图形形式呈现。该图通常称为吸收光谱,如下图4所示。
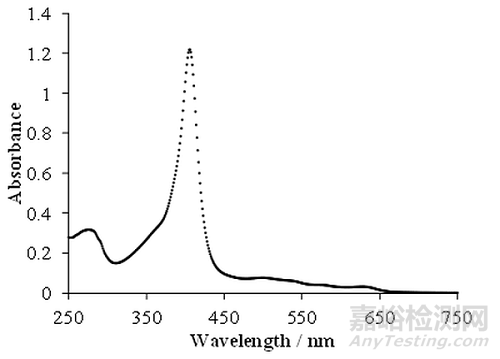
图4:从紫外-可见分光光度计获取的吸收光谱图。检查的样品是溶解在中性pH磷酸盐缓冲液中的血红蛋白。
根据本文前一节中介绍的紫外-可见分光光度计仪,可以合理地预期光强度与样品吸收的光量定量相关。
吸光度(A)等于涉及的光的强度通过样品之前的对数值(Io)通过的光的强度通过样品(I)。I除以Io的分数也称为透射率(T),它表示通过样品的光量。然而,当摩尔吸光率(ε)和路径长度(L)已知时,比尔-朗伯定律(Beer-Lambert)通常用于在测量吸光度(A)后获得样品的浓度(c)。通常,ε以L﹒mol-1cm-1为单位表示,L以cm为单位,c以mol/L为单位表示。因此,A没有单位。
有时AU用于表示任意单位或吸光度单位,但一般建议不要这样表示。
如果使用一组测量的包含相同物质的标准溶液存在线性关系,Beer-Lambert定律对于获得物质的浓度特别有用。公式1显示了吸光度、比尔-朗伯定律、仪器中测量的光强度和透射率之间的数学关系。
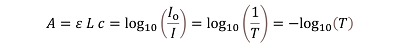
公式1:此方程显示了吸光度A、比尔-朗伯定律、仪器中测量的光强度和透射率之间的关系。
光密度(OD)有时会错误地与吸光度互换使用。OD和吸光度都测量光学组件中光强度损失的量,但OD考虑了光散射的损失,而吸光度则没有。如果测量中存在非常少的光散射,则可以使用吸光度直接近似估计OD,并且可以使用Beer-Lambert定律。
在测量过程中了解实验条件很重要。用于1cm路径长度的比色皿是标准的并且是最常见的。有时,可用于检查的样本非常少,因此需要小至1毫米的较短路径长度。如果需要定量,吸光度值应保持在1以下,并且保持在仪器的动态范围内。这是因为吸光度为1意味着样品吸收了90%的入射光,或者等效地表述为10%的入射光透过样品。由于到达检测器的光很少,一些紫外-可见分光光度计不够灵敏,无法可靠地量化少量光。解决这个问题的两个简单可能的解决方案是稀释样品或减少路径长度。
如上所述,使用“空白”参考溶液记录基线光谱是必不可少的。如果仪器在各方面都绝对完美,那么基线对每个检测波长的吸光度都为零。然而,在实际情况下,基线光谱通常会有一些非常小的正负吸光度值。为实现最佳实践,软件通常会自动从每个光波长的样品吸光度值中减去这些小的吸光度值,以获得真实的吸光度值。
根据分析的目的,可能需要构建校准曲线。建立校准曲线需要一些数据分析和额外的工作,但根据吸光度测量值准确确定样品中特定物质的浓度非常有用。然而,在许多情况下不需要校准曲线,包括用于细菌培养的OD测量、在特定波长处获取吸光度比以评估核酸纯度或识别某些药物。
在紫外可见分光光度计中,选择对应于目标物质最大吸光度的波长进行分析。这种选择确保了最大的灵敏度,因为对于特定的分析物浓度可以获得最大的响应。下图5提供了Food Green 3(一种染料)的UV-Vis吸收光谱示例和使用标准溶液的相应校准曲线。请注意,Food Green 3染料中存在两个最大吸收峰,一个较小的最大吸收峰位于435nm,在619nm处有一个更强烈的最大吸收峰。为了在计算未知浓度的Food Green 3时获得最大灵敏度,使用619nm处的最大吸光度峰进行分析。通过稀释溶液,进行吸光度测量,然后将它们绘制在吸光度与浓度的关系图上,以建立浓度和吸光度之间的数值关系,从而制备了一系列已知浓度的标准溶液。使用最小二乘线性回归方程创建校准曲线。数据点越接近直线,拟合越好。直线方程中的y截距设置为零以表示当不存在染料时没有吸光度。下图5中所示的方程用于根据测得的吸光度(变量y)计算未知样品中Food Green 3(变量x)的浓度。
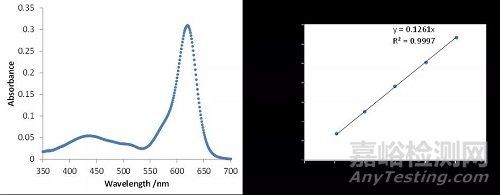
图5:左图显示了从样品中的Food Green 3的UV-Vis光谱。右图显示的校准曲线,使用最小二乘线性回归方程从Food Green 3的标准稀释溶液中得出的。
对于数据分析,吸光度与浓度的关系图可以表明系统在构建校准曲线时的灵敏度。当使用线性最小二乘回归方程时,最佳拟合线的斜率表示灵敏度。如果斜率更陡,则灵敏度更高。灵敏度是区分样品浓度微小差异的能力。根据 Beer-Lambert 定律,灵敏度可以部分地由摩尔吸收率ε 表示。事先了解ε值(如果有)有助于确定所需样品的浓度,尤其是在样品有限或昂贵的情况下。
为了可靠性和最佳实践,应重复紫外-可见光谱实验和读数。在重复检查样品时,通常至少进行3次重复试验是常见的,但在某些工作领域需要进行更多次重复试验。计算出的数量,例如未知样品的浓度,通常报告还应该带有标准偏差的平均值。可重现的结果对于确保精确、高质量的测量至关重要。标准偏差、相对标准偏差或变异系数有助于确定系统和测量的精确度,较低的偏差或变化表明较高的精度和可靠性水平。
紫外可见分光光度计的优势和局限性
没有一种技术是完美的,紫外-可见光谱也不例外。但是,该技术确实具有以下的一些主要优势,使其应用广泛。
该技术是非破坏性的,允许重复使用样品或进行进一步处理或分析;
可以快速进行测量,从而可以轻松集成到实验方案中;
仪器易于使用,使用前几乎不需要培训;
数据分析通常需要少许的处理,这同样意味着需要很少的用户培训;
该仪器的购置和操作成本通常较低,因此可供许多实验室使用。
虽然这种技术的优势看起来非常明显,但也存在一定的弱点:
杂散光
在实际仪器中,波长选择器并不完美,来自宽波长范围的少量光仍可能从光源传输,这可能会导致严重的测量错误。杂散光也可能来自环境或仪器中安装松散的隔间。
光散射
光散射通常是由液体样品中的悬浮固体引起的,这可能会导致严重的测量误差。比色皿或样品中存在的气泡会散射光,导致无法重现的结果。
来自多个吸收物种的干扰
例如,样品可以具有多种类型的绿色叶绿素。在同一样品中一起检查时,不同的叶绿素将具有重叠的光谱。为了进行适当的定量分析,应将每种化学物质从样品中分离出来并单独检查。
组件的偏差
任何仪器组件未对准定位,尤其是固定样品的比色皿,都可能产生不可重复和不准确的结果。因此,重要的是仪器中的每个组件都以相同的方向对齐,并在每次测量时放置在相同的位置。因此,一般建议进行一些基本的操作培训,以避免误差。
紫外可见分光光度计的应用
UV-Vis已发现其适用于许多用途和情况,包括但不限于:
1、DNA和RNA分析
快速验证RNA和DNA的纯度和浓度是一种特别广泛的应用。下表1中给出了分析中使用的波长及其指示的摘要。在制备DNA或RNA样品时,例如用于测序等下游应用时,通常重要的是要验证其中一个样品没有被其他,或从分离过程中携带的蛋白质或化学物质。
260nm/280nm吸光度(260/280)比值可用于揭示核酸样品中可能存在的污染,如下表2所示。纯DNA的260/280比值通常为1.8,而纯RNA的比值通常为2.0 .纯DNA的260/280比值低于RNA,因为在RNA中被尿嘧啶取代的胸腺嘧啶的260/280比值低于尿嘧啶。由于280nm处的吸光度较高,被蛋白质污染的样品会降低260/280比值。
|
用于吸光度分析的波长(nm) |
这个波长的紫外吸光度表明存在什么物质? |
是什么导致此波长的紫外线吸收? |
|
230 |
蛋白质 |
蛋白质形状 |
|
260 |
DNA和RNA |
腺嘌呤、鸟嘌呤、胞嘧啶、胸腺嘧啶、尿嘧啶 |
|
280 |
蛋白质 |
主要是色氨酸和酪氨酸 |
表1:确定260/280和260/230吸光度比值时有用的UV吸光度汇总。
|
吸光度比 |
典型值 |
|
260/280 |
纯DNA的典型吸光度比为1.8 纯RNA典型的吸光度比为2.0 |
|
260/230 |
吸光度比不同;2.15至2.50典型值用于RNA和DNA |
表2:DNA和RNA分析的预期紫外线吸光度比值总结。
260nm/230nm吸光度(260/230)比率也可用于检查DNA和RNA样品的纯度,并可揭示蛋白质或化学污染。蛋白质可以吸收230nm的光,从而降低260/230比率并指示DNA和RNA样品中的蛋白质污染。硫氰酸胍和异硫氰酸胍是纯化核酸中常用的两种化合物,在230nm处有强烈吸收,这也会降低260/230的吸光度比值。
2、药物分析
UV-Vis光谱最常见的用途之一是在制药行业。使用数学导数处理UV-Vis光谱允许解析原始光谱中的重叠吸收峰以识别单个药物化合物。例如,苯佐卡因(一种局部麻醉剂)和金霉素(一种抗生素)可以通过将第一个数学导数应用于吸光度光谱,同时在商业兽用粉末制剂中进行鉴定。通过为每种化合物构建校准函数,可以在微克/毫升的浓度范围内同时定量这两种物质。
3、细菌培养
紫外可见分光光度计常用于细菌培养。OD测量通常使用600nm的波长快速进行,以估计细胞浓度并跟踪生长。600nm是常用和优选的,因为它们在其中生长的细菌培养基的光学特性以及避免在需要继续实验的情况下损坏细胞。
4、饮料分析
识别饮料中的特定化合物是紫外可见光谱的另一个常见应用。咖啡因含量必须在一定的法律限制内,紫外线可以促进量化。某些类别的有色物质,例如在蓝莓、覆盆子、黑莓和樱桃中发现的花青素,可以通过匹配它们在葡萄酒中的已知峰值吸收波长来轻松识别,以便使用紫外可见吸收进行质量控制。
5、其他应用
这种技术也可用于许多其他行业。例如,测量颜色指数可用于监控变压器油,作为确保电力安全输送的预防措施。测量血红蛋白的吸光度以确定血红蛋白浓度可用于癌症研究。在废水处理中,UV-Vis光谱可用于动力学和监测研究,通过比较一段时间内的光谱,确保某些染料或染料副产品已被正确去除。
UV-Vis光谱在一些更专业的研究中也非常有用。在对应于吸收峰的波长的跟踪变化是在检查特定结构蛋白改变有用和在确定电池组合物。峰值吸收波长的偏移也可用于更现代的应用,例如非常小的纳米粒子的表征。这种技术的应用多种多样,而且似乎无穷无尽。
图片参考:
1.Harris DC. Quantitative Chemical Analysis. 7th ed, 3rd printing.W. H. Freeman; 2007.
2.Diffey BL.Sources and measurement of ultraviolet radiation. Methods. 2002;28(1):4-13.doi:10.1016/S1046-2023(02)00204-9
3.Namioka T.Diffraction Gratings. In: Vacuum Ultraviolet Spectroscopy. Vol 1. ExperimentalMethods in Physical Sciences. Elsevier; 2000:347-377. doi:10.1016/B978-012617560-8/50018-9
4.MortimerAbramowitz and Michael W. Davidson. Photomultiplier Tubes. MolecularExpressions. Accessed April 25, 2021. https://micro.magnet.fsu.edu/primer/digitalimaging/concepts/photomultipliers.html
5.Picollo M,Aceto M, Vitorino T. UV-Vis spectroscopy. Phys Sci Rev. 2019;4(4). doi:10.1515/psr-2018-0008
6.What is aPhotodiode? Working, Characteristics, Applications. Published online October30, 2018. Accessed April 29, 2021. https://www.electronicshub.org/photodiode-working-characteristics-applications/
7.Amelio G.Charge-Coupled Devices. Scientific American. 1974;230(2):22-31. http://www.jstor.org/stable/24950003
8.Hackteria. DIYNanoDrop. Accessed June 15, 2021. https://hackteria.org/wiki/File:NanoDropConceptSpectrometer2.png
9.Sharpe MR.Stray light in UV-VIS spectrophotometers. Anal Chem. 1984;56(2):339A-356A. doi:10.1021/ac00266a003
10.Liu P-F,Avramova LV, Park C. Revisiting absorbance at 230nm as a protein unfoldingprobe. Anal Biochem. 2009;389(2):165-170. doi:10.1016/j.ab.2009.03.028
11.Kalb V.,Bernlohr R. A New Spectrophotometric Assay for Protein in Cell Extracts. AnalBiochem. 1977;82:362-371. doi:10.1016/0003-2697(77)90173-7
12.Bosch Ojeda C,Sanchez Rojas F. Recent applications in derivative ultraviolet/visibleabsorption spectrophotometry: 2009–2011. Microchem J. 2013;106:1-16. doi:10.1016/j.microc.2012.05.012
13.Domingo C,Saurina J. An overview of the analytical characterization of nanostructureddrug delivery systems: Towards green and sustainable pharmaceuticals: A review.Anal Chim Acta. 2012;744:8-22. doi:10.1016/j.aca.2012.07.010
14.Gaikwad J,Sharma S, Hatware KV. Review on Characteristics and Analytical Methods ofTazarotene: An Update. Crit Rev Anal Chem. 2020;50(1):90-96. doi:10.1080/10408347.2019.1586519
15.Gendrin C,Roggo Y, Collet C. Pharmaceutical applications of vibrational chemical imagingand chemometrics: A review. J Pharm Biomed Anal. 2008;48(3):533-553. doi:10.1016/j.jpba.2008.08.014
16.Lourenço ND,Lopes JA, Almeida CF, Sarraguça MC, Pinheiro HM. Bioreactor monitoring withspectroscopy and chemometrics: a review. Anal Bioanal Chem.2012;404(4):1211-1237. doi:10.1007/s00216-012-6073-9
17.Sánchez RojasF, Bosch Ojeda C. Recent development in derivative ultraviolet/visibleabsorption spectrophotometry: 2004–2008. Anal Chim Acta. 2009;635(1):22-44.doi:10.1016/j.aca.2008.12.039
18.Stevenson K,McVey AF, Clark IBN, Swain PS, Pilizota T. General calibration of microbialgrowth in microplate readers. Sci Rep. 2016;6(1):38828. doi:10.1038/srep38828
19.TadesseWondimkun Z. The Determination of Caffeine Level of Wolaita Zone, EthiopiaCoffee Using UV-visible Spectrophotometer. Am J Appl Chem. 2016;4(2):59. doi:10.11648/j.ajac.20160402.14
20.Yu J, Wang H,Zhan J, Huang W. Review of recent UV–Vis and infrared spectroscopy researcheson wine detection and discrimination. Appl Spectrosc Rev.2018;53(1):65-86. doi:10.1080/05704928.2017.1352511
21.Leong Y, KerP, Jamaludin M, et al. UV-Vis Spectroscopy: A New Approach for Assessing theColor Index of Transformer Insulating Oil. Sensors. 2018;18(7):2175. doi:10.3390/s18072175
22.Brown JQ,Vishwanath K, Palmer GM, Ramanujam N. Advances in quantitative UV–visiblespectroscopy for clinical and pre-clinical application in cancer. Curr OpinBiotechnol. 2009;20(1):119-131. doi:10.1016/j.copbio.2009.02.004
23.Pinheiro HM,Touraud E, Thomas O. Aromatic amines from azo dye reduction: status review withemphasis on direct UV spectrophotometric detection in textile industrywastewaters. Dyes Pigm. 2004;61(2):121-139. doi:10.1016/j.dyepig.2003.10.009
24.Kristo E,Hazizaj A, Corredig M. Structural Changes Imposed on Whey Proteins by UV Irradiationin a Continuous UV Light Reactor. J Agric Food Chem. 2012;60(24):6204-6209.doi:10.1021/jf300278k
25.Lange R, BalnyC. UV-visible derivative spectroscopy under high pressure. Biochim Biophys ActaBBA - Protein Struct Mol Enzymol. 2002;1595(1-2):80-93. doi:10.1016/S0167-4838(01)00336-3
26.Tom J, JakubecPJ, Andreas HA. Mechanisms of Enhanced Hemoglobin Electroactivity on CarbonElectrodes upon Exposure to a Water-Miscible Primary Alcohol. Anal Chem.2018;90(9):5764-5772. doi:10.1021/acs.analchem.8b00117
27.Patel MUM,Demir-Cakan R, Morcrette M, Tarascon J-M, Gaberscek M, Dominko R. Li-S BatteryAnalyzed by UV/Vis in Operando Mode. ChemSusChem. 2013;6(7):1177-1181. doi:10.1002/cssc.201300142
28.Begum R,Farooqi ZH, Naseem K, et al. Applications of UV/Vis Spectroscopy inCharacterization and Catalytic Activity of Noble Metal Nanoparticles Fabricatedin Responsive Polymer Microgels: A Review. Crit Rev Anal Chem.2018;48(6):503-516. doi:10.1080/10408347.2018.1451299
29.Behzadi S,Ghasemi F, Ghalkhani M, et al. Determination of nanoparticles using UV-Visspectra. Nanoscale. 2015;7(12):5134-5139. doi:10.1039/C4NR00580E

来源:药时空


