您当前的位置:检测资讯 > 科研开发
嘉峪检测网 2021-07-06 14:20
更多医药技术资讯,请点击医药专栏:http://drug.anytesting.com/ 欢迎关注文末微信公众号:药研检测drugtest
今日头条
注射用左亚叶酸钠获批上市。汇伦医药旗下注射用左亚叶酸钠获国家药监局批准上市,用于叶酸拮抗剂(例如甲氨蝶呤)化疗、过量时使用,以减轻其毒性、抵消其作用;以及用于化疗中,与氟尿嘧啶类药物联用治疗胃癌和结直肠癌患者。亚叶酸是叶酸还原型的甲酰化衍生物,系叶酸在体内的活化形式。据悉,这是中国首款获批的注射用左亚叶酸钠。
国内药讯
1.乐普生物PD-1抗体报产。乐普生物PD-1抗体普特利单抗注射液(HX008)的新药上市申请获CDE受理。乐普生物此前曾宣布,该公司计划于2021年分别就HX008治疗黑色素瘤和卫星不稳定(MSI-H)/错配修复功能缺陷(dMMR)实体瘤向NMPA提交新药上市申请。目前,HX008还有多项临床试验正在进行当中,包括胃癌或胃食管结合部癌二线治疗的Ⅲ期临床、非小细胞肺癌的Ⅱ/Ⅲ期临床,以及分别针对三阴性乳腺癌、非肌层浸润性膀胱癌等适应症的Ⅱ期临床等。
2.二甲双胍迟释片获批Ⅲ期临床。安济药业针对2型糖尿病合并中重度慢性肾病的二甲双胍迟释片ANJ900获国家药监局批准,即将开展桥接试验和关键性临床试验。ANJ900是一款靶向回肠的二甲双胍迟释剂型,选择在小肠末端释放药物,通过局部暴露激活回肠部位的L细胞以达到降糖效果。目前,该公司正在开展一项全球关键性Ⅲ期临床DREAM-T2D,评估ANJ900用以有效管理合并中重度慢性肾病的二型糖尿病患者的血糖水平。
3.创胜Claudin18.2单抗早期临床积极。创胜集团抗Claudin18.2单抗TST001在单药剂量爬坡试验中获积极结果。6mg/kg TST001组有1例(n=3)接受过多线治疗失败的晚期胃癌患者在治疗近6周后达到部分缓解,肿瘤生物标志物也明显迅速减少。在TST001联合CAPOX一线治疗胃癌的研究中,第一个剂量组中有1例患者在治疗6周后也获得部分缓解。该公司计划今年第四季度启动对Claudin18.2表达的实体瘤(包括胃癌、胰腺癌等其他肿瘤)的临床。
4.诺和诺德PCSK9抑制剂国内报IND。诺和诺德PCSK9抑制剂NNC0385-0434片临床试验申请获CDE受理。PCSK9是一种神经细胞凋亡调节转化酶,不但参与肝脏再生,调节神经细胞凋亡,还能与肝细胞表面的低密度脂蛋白受体(LDLR)结合,干扰LDLR的再循环,降低肝脏从血液中清除LDL-C能力,进而导致高胆固醇血症。目前国内仅有2款PCSK9抑制剂获批上市,均为注射剂,分别是赛诺菲的阿利西尤单抗和安进的伊洛尤单抗。
5.罗氏PD-1/LAG-3双抗国内报IND。罗氏PD-1/LAG-3双抗新药RO7247669注射液的临床试验申请获CDE受理。LAG-3是免疫疗法领域的前沿热门靶点之一,它能够调控T淋巴细胞和抗原呈递细胞(APCs)的信号通路,在适应性免疫反应中起重要作用。LAG-3和PD-1介导不同的信号通路,而且能产生协同作用,导致效应T细胞的耗竭。目前该公司正在多项临床中评估RO7247669治疗转移性黑色素瘤、非小细胞肺癌、食管鳞状细胞癌等多种癌症的潜力。本次是该药首次在中国申报临床。
国际药讯
1.优时比IL-17A/F抑制剂获欧盟CHMP推荐。欧洲药品管理局人用药品委员会(CHMP)推荐批准优时比在研IL-17A/IL-17F抑制剂bimekizumab上市,用于治疗适合接受全身性治疗的中重度斑块状银屑病患者。如果获批,bimekizumab将成为首个获批治疗银屑病的IL-17A/IL-17F双重抑制剂。在美国,Bimekizumab的监管申请目前也正在审批过程中,预计在今年10月获得回复。
2.默沙东GLP-1/GCGR激动剂上IIa期临床。默沙东在美国登记启动一项GLP-1/GCGR激动剂Efinopegdutide (MK-6024)与诺和诺德司美格鲁肽(semaglutide)相比,用于治疗非酒精性脂肪肝(NAFLD)的头对头IIa期临床试验。该项研究计划招募130例受试者,分别接受每周注射Efinopegdutide或每周注射semaglutide治疗。研究的主要终点为:Efinopegdutide优于semaglutide或24周后,efinopegdutide组患者肝脂肪含量(LFC)相对于基线平均降低水平优于semaglutide至少10%。
3.治疗DMD新药长期疗效积极。日本新药株式会社子公司NS Pharma的磷酰二胺吗啉代寡聚核苷酸药物Viltepso(viltolarsen),在治疗杜氏肌营养不良(DMD)的Ⅱ期临床中获长期疗效数据。与历史对照组相比,Viltepso治疗组在第73周和第109周时,多项运动功能指标显著改善。其中,Viltepso组从仰卧位至站立位用时较基线平均变化分别为增加0.21秒和0.43秒,而历史对照组这一数值则分别增加3.6秒和4.3秒(p<0.01)。在中国,Viltepso已向NMPA递交了新药上市申请。
4.白细胞介素肿瘤免疫疗法III期结果失败。CEL-SCI公司公布白细胞介素免疫疗法Multikine治疗晚期原发头颈部鳞状细胞癌患者的关键III期研究结果。与标准治疗相比,Multikine联合标准治疗未能达到总生存期改善10%的主要终点;但低风险患者(无化疗)亚组的OS具有统计学意义的显著改善(p=0.0236, HR=0.68),其3年生存优势为4.9% (72.4%vs67.5%),5年生存优势为14.1% (62.7%vs48.6%)。CEL-SCI计划基于这一亚组中OS结果向FDA寻求在类患者中使用Multikine作为免疫治疗的批准。
5.Apellis联手Beam开发碱基编辑疗法。Apellis Pharmaceuticals与Beam Therapeutics达成一项为期五年的研究合作和许可协议,将利用Beam专有的碱基编辑平台,开发补体驱动疾病的新疗法。根据协议,Beam将负责对6个项目进行临床前研究,而Apellis将拥有所有项目的独家许可权,并负责后续开发;Beam将获得5000万美元的前期付款,以及合作一周年时额外获得2500万美元的付款。此外,Beam拥有与Apellis在美国共同开发与商业化合作项目的选择权。
6.默沙东和Alpine合作免疫肿瘤学研究。Alpine Immune Sciences首创靶向CD28的双检查点抑制剂ALPN-202拟与默沙东PD-1疗法Keytruda开展联合用药研究NEON-2,评估这一组合治疗癌症的有效性和安全性。在ASCO2021年会上发布的最新数据显示,许多对免疫疗法无反应的肿瘤患者使用ALPN-202获得了临床益处。ALPN-202也显示出克服T细胞抑制和提高工程T细胞抗肿瘤反应耐久性的能力。
医药热点
1.中国上市药品专利信息登记平台启动。国家药监局、国家知识产权局共同制定的《药品专利纠纷早期解决机制实施办法(试行)》日前发布。为做好实施工作,国家药监局宣布4日起正式运行中国上市药品专利信息登记平台(网址:https://zldj.cde.org.cn/home)。即日起,申请人提交化学仿制药、中药同名同方药、生物类似药上市注册申请时,应当对照已在该登记平台公开的相关药品专利信息,按《办法》要求提交专利声明,并将声明及声明依据通知上市许可持有人。
2.云南瑞丽启动突发公卫事件Ⅲ级响应。云南瑞丽新闻发布会通报,7月4日0时至24时,云南省瑞丽市新增本土确诊病例3例(中国籍2例,缅甸籍1例)。据悉,这3例确诊病例(普通型2例、轻型1例)均是该市按计划开展常态化全员核酸检测中发现,均在姐告。目前,瑞丽市已启动突发公共卫生事件Ⅲ级响应,关闭离瑞通道和线上离瑞审批功能,并有序进行流调工作。
3.中国成人平均体重指数增速放缓。《柳叶刀》刊发了题为《中国城乡平均体重指数和肥胖:2004至2018年全国代表性调查结果》的研究论文。该研究重点关注中国城乡不同特征成人平均体重指数(BMI)及超重和肥胖变化趋势。结果显示,2004年—2018年,中国成人平均BMI呈总体上升趋势,但2010年以后,其增速放缓,仅为2004年—2010年增速的一半;同时,2010年后成人超重率和肥胖率的增长幅度也略低于2010年前。
审评动向
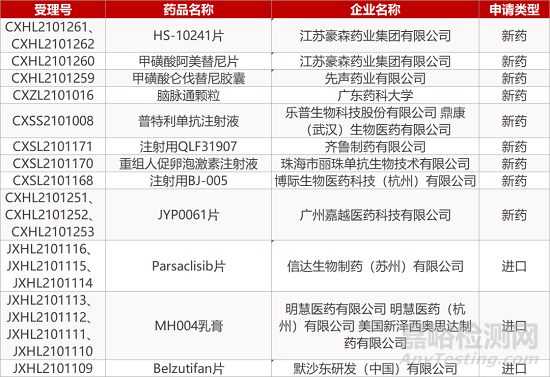

来源:药研发


